
 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 该电池的内电路中,阳离子向负极迁移 | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
分析 A.金属镁和氢氧化钠溶液不能发生氧化还原反应;
B.铝片表面的氧化膜也能与NaOH溶液反应;
C.阳离子的移动方向与电流方向一致,结合电流方向判断;
D.铝离子在过量的碱性溶液中不会产生氢氧化铝沉淀.
解答 解:A.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,而属镁和氢氧化钠溶液不能发生氧化还原反应,故A错误;
B.由于Al片表面的氧化膜也能与NaOH溶液反应,故其不必处理,故B正确;
C.Al为负极、Mg为正极,电流从Mg流向Al,内电路中电流从Al流向Mg,则溶液中阳离子向正极Mg移动,故C错误;
D.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,由于电池开始工作时,生成的铝离子的量较少,NaOH过量,此时不会有Al(OH)3白色沉淀生成,故D错误;
故选B.
点评 本题考查了原电池原理,题目难度不大,正确判断原电池正负极是解本题关键,根据各个电极上发生的反应以及铝的化合物的性质来分析解答.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
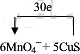
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有2 NA个碳原子 | |
| B. | 7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 1molCH4O中含有C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素性质呈现周期性的变化的根本原因是核外电子排布呈周期性变化 | |
| B. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 凡是含碳元素的化合物都属于有机化合物 | |
| D. | 甲烷化学性质稳定,点燃前不必验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
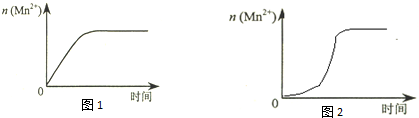
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | 再向试管中加入少量固体 | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | |||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2molSO3气体通入一密闭容器中,反应达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| B. | 向20mL0.5mol•L-1FeBr2溶液中通入224mL Cl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液 Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀::2Ba2++Al3++2SO42-+4OH-═2H2O+2BaSO4↓+AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
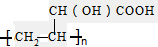
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12溶液中:Na+、Ca2+、HCO3-、ClO- | |
| B. | 在能使石蕊变红的溶液中:Mg2+、K+、Br-、SO4 2- | |
| C. | 在0.1mol•L-1的NaHCO3 溶液中:K+、Al3+、I-、Cl- | |
| D. | 在与Al 反应能放出H2 的溶液中:Fe2+、K+、NO3-、SO4 2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com