

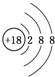
 .元素K名称为氯在周期表中的位置第三周期第ⅦA族.
.元素K名称为氯在周期表中的位置第三周期第ⅦA族.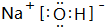
 HClO+HCl.
HClO+HCl. 分析 由元素在周期表中位置,可知A为氢,B为Na,C为Mg,D为Al,E为碳,F为Si,G为氮,H为磷,I为氧,J为硫,K为Cl,L为Ar.
(1)稀有气体原子最外层为稳定结构,Ar化学性质最不活泼;K为氯元素,由位置可知处于第三周期第ⅦA族;
(2)最高价氧化物水化物中碱性最强为NaOH;
(3)某元素二价阳离子的核外有10个电子,该元素核外电子数为12,故为Mg;
(4)非金属性越强,对应氢化物越稳定;
(5)非金属性越强,最高价氧化物对应水化物的酸性越强;
(6)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(7)元素I的氢化物为H2O,氯气与水反应生成HCl与HClO.
解答 解:由元素在周期表中位置,可知A为氢,B为Na,C为Mg,D为Al,E为碳,F为Si,G为氮,H为磷,I为氧,J为硫,K为Cl,L为Ar.
(1)稀有气体原子最外层为稳定结构,Ar化学性质最不活泼,原子结构示意图为 ;K为氯元素,由位置可知处于第三周期第ⅦA族,
;K为氯元素,由位置可知处于第三周期第ⅦA族,
故答案为:Ar; ;氯;第三周期第ⅦA族;
;氯;第三周期第ⅦA族;
(2)最高价氧化物水化物中碱性最强为NaOH,电子式为: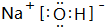 ,
,
故答案为: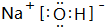 ;
;
(3)某元素二价阳离子的核外有10个电子,该元素核外电子数为12,故为Mg,
故答案为:镁;
(4)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,对应氢化物越稳定,故氢化物稳定性:H2O>NH3>PH3,
故答案为:H2O>NH3>PH3;
(5)非金属性Cl>P>Si,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:H2SO4>H3PO4>H2SiO3,
故答案为:H2SO4>H3PO4>H2SiO3;
(6)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->Cl->O2-,
故答案为:S2->Cl->O2-;
(7)元素I的氢化物为H2O,结构式为H-O-H,氯气与水反应生成HCl与HClO,反应方程式为:Cl2+H2O HClO+HCl,
HClO+HCl,
故答案为:H-O-H;Cl2+H2O HClO+HCl.
HClO+HCl.
点评 本题考查元素周期表与元素周期律综合运用,熟练掌握前四周期元素,理解掌握元素周期律,比较基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 . (加聚反应)
. (加聚反应) . (取代反应)
. (取代反应)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0摩尔 | B. | 1.6摩尔 | C. | 2.2摩尔 | D. | 2.0摩尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
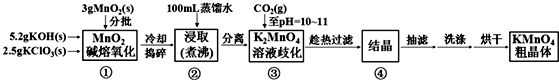
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com