
| A、①溶液中:c(A?)>c(Na+)>c(OH?)>c(H+) |
| B、①溶液中:c(HA)+c(A-)=0.1mol/L |
| C、常温下,0.1mol/LHA溶液的pH=1 |
| D、0.1mol/LHA溶液中:c(HA)>c(A?) |


科目:高中化学 来源: 题型:
| A、煤的干馏和石油的分馏均属于化学变化 |
| B、将碘酒滴在鸡蛋清中,可观察到鸡蛋清显蓝色 |
| C、乙酸的酯化反应和苯的硝化反应属于同种反应类型 |
| D、乙烯能够发生加成反应,结构简式为CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
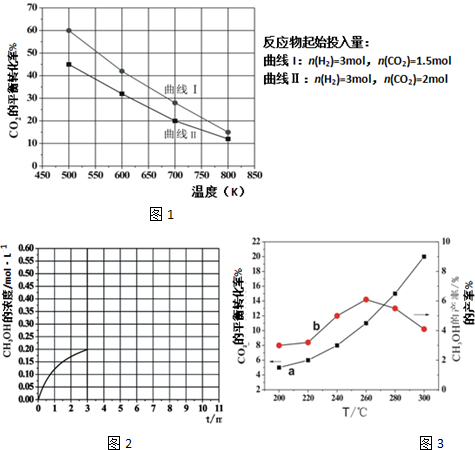
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O和Na2O2组成元素相同,化学性质也完全相同 |
| B、向硫酸铝溶液中逐滴加人过量氢氧化钡溶液,会出现先沉淀后完全溶解的现象 |
| C、等物质的量浓度的NH4Cl和CH3COONH4溶液中的c( NH4+)相等 |
| D、高纯度二氧化硅广泛用于制光导线维,光导纤维遇强碱时会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应用高效洁净的能源转换技术,在大型燃煤锅炉上安装低氮燃烧器,并采用烟气脱硝技术 |
| B、加强道路扬尘控制强化路面保洁洒水防尘 |
| C、推广和使用脱硫技术,降低硫氧化物的排放 |
| D、研究采煤、采油新技术增加汽油、柴油等能源的供应量,提倡以汽车代步的现代消费与生活理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在铁质船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B、粗铜精炼时,电镀液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的电化学腐蚀 |
| D、外加电流的阴极保护法是将被保护的金属与外加电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
134 55 |
137 55 |
| A、铯元素的相对原子质量约为133 | ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1L0.1mol/L AlCl3溶液中含有0.1NA个Al3+ |
| B、Na2O2与足量水反应,每生成0.1molO2转移的电子数为0.2NA |
| C、标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.2NA |
| D、标准状况下,11.2L四氯化碳中含有的C-Cl键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Al3+、ClO-、Cl- |
| B、Na+、Mg2+、AlO2-、Br- |
| C、NH4+、Na+、Br-、SO42- |
| D、Mg2+、H+、S2O32-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com