
| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:解答题
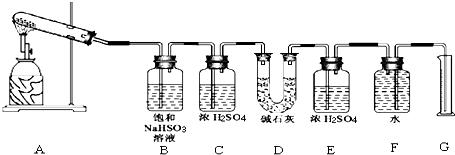
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2.56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | NaCl | C. | BaSO4 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,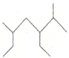 的名称为2-甲基-3,5-二乙基己烷 的名称为2-甲基-3,5-二乙基己烷 | |
| B. | 用Na2C03溶液能区分CH3CO0H、CH3CH2OH、苯和硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所消耗氧气的量依次增加 | |
| D. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自发反应都是放热反应 | B. | 自发反应都是熵增加的反应 | ||
| C. | 自发反应都是△G<0的反应 | D. | 自发反应都是△G>0的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.
,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com