
【题目】硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
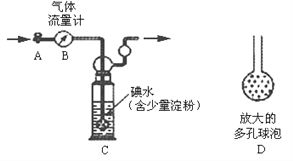
(1)洗气瓶C中发生反应的化学方程式为:_______________;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:___________________;
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量将_________(填“偏高”、“偏低”或“无影响”);
(4)下列试剂中,可以用来替代洗气瓶C中溶液的是_________。(选填字母编号)
a.NaOH溶液 b.品红溶液
c.酸性高锰酸钾溶液 d.Na2CO3溶液
乙方案:实验步骤如以下流程图所示:
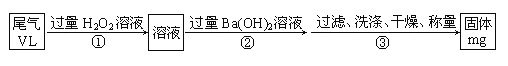
(5)写出步骤②中反应的离子方程式;_________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为________________(用含V、m的代数式表示)
【答案】 SO2+I2+2H2O=H2SO4+2HI 增大SO2和碘水的接触面积 偏低; c Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O ![]()
【解析】本题考查实验方案设计与评价,(1)I2的氧化性强于SO2,洗气瓶中发生的化学反应方程式为SO2+I2+2H2O=H2SO4+2HI;(2)增加SO2与I2的接触面积,使之充分被吸收;(3)没有及时关闭活塞A,造成尾气体积增大,即总体积增大,而蓝色溶液消失,说明I2恰好完全反应,即所测的SO2的含量将偏低;(4)I2的淀粉溶液显蓝色,当蓝色恰好消失,说明反应完全进行,因此能够代替洗气瓶C中溶液,必须有明显现象,a、NaOH与SO2反应没有明显现象,因此不能用NaOH代替,故a错误;b、SO2虽然能使品红溶液褪色,但品红溶液只是验证SO2的存在,不能吸收SO2,无法计算SO2的含量,故b错误;c、酸性高锰酸钾溶液具有强氧化性,能把SO2氧化成SO42-,且紫红色褪去,因此可以用高锰酸钾溶液代替,故c正确;d、SO2与Na2CO3产生CO2,根据此装置无法计算SO2的含量,故d错误;(5)反应①发生的离子反应是H2O2+SO2=2H++SO42-,加入过量Ba(OH)2溶液,则反应②的离子反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;(6)根据过程最后得到固体为BaSO4,根据硫酸守恒,n(SO2)=n(BaSO4)=m/233mol,则SO2含量为22.4m/233V。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
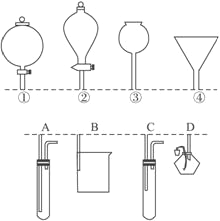
【题目】如下图所示,①②③④分别是几种常见漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品均已略去,铁架台、铁夹也已略去)。请根据实际使用操作时上述漏斗的使用范围和它们的形状,指出A、B、C、D分别与①②③④中哪一种最为匹配:A与_____________,B与______________,C与_______________,D与_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
A.16O2与18O2互为同分异构体
B.16O和18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅酸钠以下说法不正确的是( )
A. 硅酸钠与盐酸反应的离子方程式:SiO32—+2H+=H2SiO3↓
B. 硅酸钠溶液俗称“泡花碱”,其溶液显碱性,滴加酚酞显红色
C. Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
D. 水玻璃久置在空气中变质,因为与空气中的CO2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质的重要组成元素之一,以氮气为原料的合成氨工业可以实现大规模固氮,氨可用于生成氯化铵、硫酸铵等化学肥料。
(1)科学家已成功合成少量N4分子,N4和N2互为_____,NH3分子的空间构型为型______。
(2)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标况下)氮气,至少需要叠氮酸钠_____g,转移电子____个。
(3)检验铵态氮肥中铵根离子的实验方案是(补充写出步骤,现象):取样,溶于水_________________________________________________。
(4)等物质的量浓度的两溶液,pH大小为:氯化铵__________硫酸铵(选填>、=或< ,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵_____硫酸铵;
最新“人工固氮”的研究报道:常温常压、催化剂条件下, N2在催化剂表面与水发生反应:与水发生反应: 2N2(g)+6H2O(g)![]() 4NH3(g)+3O2(g)-Q,(Q>0)
4NH3(g)+3O2(g)-Q,(Q>0)
(5)如果反应的平衡常数K值变小,该反应正反应速率_______ (选填增大、减小或不变,下同),逆反应速率_______.
(6)若反应在恒容条件下进行,请用上述反应中的有关物理量来说明该反应已达到平衡状态_______.
(7)下列能够提高氮气转化率的措施是:_____
A.适当升高温度 b.增加水的用量
C.使用高效催化剂 d.扩大容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则

A. M点所示溶液的导电能力强于Q点
B. N点所示溶液中c(CH3COO-)>c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________。
(2)第四周期中,与铝未成对电子数相同的金属元素有________种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为_________,HClO3中Cl原子的杂化轨道类型为________,HClO2中含有的共价键类型为__________。以上几种含氧酸的酸性强弱不同,其原因为______________。
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________,影响ΔH2递变的因素为______________。

(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是
A. 放电时,Li+在电解质中由负极向正极迁移
B. 充电时,若转移1mole-,石墨C6电极将增重7xg
C. 放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
D. 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com