
分析 依据盖斯定律将已知热化学方程式(1)和(2)进行变形处理,即(1)-(2)即可得出目标方程式,然后计算反应热即可.
解答 解:(1)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(2)CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
依据盖斯定律(1)-(2)得C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1,故答案为:-110.5kJ•mol-1.
点评 本题考查了燃烧热的概念,反应热的求算,题目难度中等,反应热的求算可以依据盖斯定律,也可以依据反应物和生成物键能差计算,本题利用盖斯定律,难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
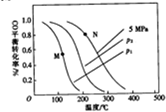 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)| 方法 | 催化剂 | 条件 | 备注 | 特点 | |
| 压力/MPa | 温度/℃ | ||||
| 高压法 | ZnO-Cr2O3 二元催化剂 | 25-30 | 380-400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
| 低压法 | CuO-ZnO-Al2O3 三元催化剂 | 5 | 230-270 | 1966年工业化 | (1)催化剂易中毒,再生容易 (2)副反应少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
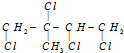 ,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )| A. | 2-丁炔 | B. | 2-甲基-1,3-丁二烯 | ||
| C. | 1,3-丁二烯 | D. | 1,4-二氯-2-甲基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | 2Fe3++H2S═2Fe2++S↓+2H+ | ||
| C. | I2+SO2+2H2O═2I-+SO42-+4H+ | D. | 2Br-+SO42-+4H+═Br2+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只可能为离子化合物 | |
| C. | Y、Z两元素形成的化合物均会对空气造成污染 | |
| D. | 稳定性:Y的氢化物大于Z的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙醇 | B. | 苯酚和苯甲醇 | C. | 甲烷和乙酸 | D. | 乙炔和乙醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com