
ЁОЬтФПЁПЦћГЕЮВЦјЪЧГЧЪаПеЦјЕФжївЊЮлШОЮяЃЌШчКЮМѕЩйЦћГЕЮВЦјЃЈCOЁЂNOxЕШЃЉЕФЮлШОЪЧживЊЕФПЦбЇбаОППЮЬтЁЃ
ЃЈ1ЃЉвЛЖЈЬѕМўЯТЕФУмБеШнЦїжаЃЌНјааЗДгІЃК2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ЃЌЯТСаЫЕЗЈВЛФмЫЕУїИУЗДгІДяЕНЦНКтЕФЪЧ____ЃЈЬюзжФИЃЉЁЃ
N2(g)+2CO2(g)ЃЌЯТСаЫЕЗЈВЛФмЫЕУїИУЗДгІДяЕНЦНКтЕФЪЧ____ЃЈЬюзжФИЃЉЁЃ
AЃЎNOЕФЩњГЩЫйТЪгыNOЕФЯћКФЫйТЪЯрЕШ BЃЎІд(CO)=Ід(CO2)
CЃЎЬхЯЕЕФбЙЧПБЃГжВЛБф DЃЎИїЮяжЪЕФХЈЖШБЃГжВЛБф
ЃЈ2ЃЉПЩгУЛюадЬПЛЙдЗЈДІРэЕЊбѕЛЏЮяЁЃгаЙиЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКCЃЈsЃЉ+2NOЃЈgЃЉ![]() N2ЃЈgЃЉ+CO2ЃЈgЃЉЁїHЃО0ФГбаОПаЁзщЯђУмБеШнЦїМгШывЛЖЈСПЕФЛюадЬПКЭNOЃЌКуЮТЃЈT1ЁцЃЉЬѕМўЯТЗДгІЃЌЗДгІНјааЕНВЛЭЌЪБМфВтЕУИїЮяжЪЕФХЈЖШШчЯТЃК
N2ЃЈgЃЉ+CO2ЃЈgЃЉЁїHЃО0ФГбаОПаЁзщЯђУмБеШнЦїМгШывЛЖЈСПЕФЛюадЬПКЭNOЃЌКуЮТЃЈT1ЁцЃЉЬѕМўЯТЗДгІЃЌЗДгІНјааЕНВЛЭЌЪБМфВтЕУИїЮяжЪЕФХЈЖШШчЯТЃК
ХЈЖШ/molЁЄLЉ1 ЪБМф/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
ЂйаДГіИУЗДгІЕФЦНКтГЃЪ§БэДяЪНЃКK=____________________ЁЃ
Ђк30minКѓЃЌИФБфФГвЛЬѕМўЃЌЦНКтЗЂЩњСЫвЦЖЏЃЌдђИФБфЕФЬѕМўЪЧ_______________ЃЛШєЩ§ИпЮТЖШЃЌNOХЈЖШНЋ_______ЃЈЬюЁАдіДѓЁБЁЂЁАВЛБфЁБЛђЁАМѕаЁЁБЃЉЁЃ
ЂлМЦЫуДг0ЁЋ20minФкЃЌNOЕФЦНОљЗДгІЫйТЪЮЊ___________________ЁЃ
ЃЈ3ЃЉдквЛЖЈЮТЖШКЭбЙЧПЯТЃЌCOКЭH2ДпЛЏКЯГЩЖўМзУбЕФЗДгІЮЊЃК3H2ЃЈgЃЉ+3COЃЈgЃЉ![]() CH3OCH3ЃЈgЃЉ+CO2ЃЈgЃЉЃЌШєвЛЬхЛ§ПЩБфЕФУмБеШнЦїжаГфШы3 mol H2ЁЂ3 mol COЁЂ1 mol CH3OCH3ЁЂ1 mol CO2ЃЌОвЛЖЈЪБМфДяЕНЦНКтЃЌВЂВтЕУЦНКтЪБЛьКЯЦјЬхУмЖШЪЧЭЌЮТЭЌбЙЯТЦ№ЪМЪБЕФ1.6БЖЁЃдђЃКЗДгІПЊЪМЪБе§ЁЂФцЗДгІЫйТЪЕФДѓаЁЃКІд(е§ЃЉ____Ід(Фц)ЃЈЬюЁА >ЁБЁЂЁА < ЁБЛђЁА=ЁБЃЉЁЃ
CH3OCH3ЃЈgЃЉ+CO2ЃЈgЃЉЃЌШєвЛЬхЛ§ПЩБфЕФУмБеШнЦїжаГфШы3 mol H2ЁЂ3 mol COЁЂ1 mol CH3OCH3ЁЂ1 mol CO2ЃЌОвЛЖЈЪБМфДяЕНЦНКтЃЌВЂВтЕУЦНКтЪБЛьКЯЦјЬхУмЖШЪЧЭЌЮТЭЌбЙЯТЦ№ЪМЪБЕФ1.6БЖЁЃдђЃКЗДгІПЊЪМЪБе§ЁЂФцЗДгІЫйТЪЕФДѓаЁЃКІд(е§ЃЉ____Ід(Фц)ЃЈЬюЁА >ЁБЁЂЁА < ЁБЛђЁА=ЁБЃЉЁЃ
ЁОД№АИЁП B ![]() МѕЩйCO2ХЈЖШ МѕаЁ 0.003mol/ЃЈLЁЄmin >
МѕЩйCO2ХЈЖШ МѕаЁ 0.003mol/ЃЈLЁЄmin >
ЁОНтЮіЁП(2)2NO(g)+2CO(g)N2(g)+2CO2(g)ЃЌЗДгІЪЧЦјЬхЬхЛ§МѕаЁЕФЗДгІЃЛAЃЎNOЕФЩњГЩЫйТЪгыNOЕФЯћКФЫйТЪЯрЕШЪЧЦНКтБъжОЃЌЙЪAе§ШЗЃЛBЃЎЗДгІЫйТЪжЎБШЕШгкЛЏбЇЗНГЬЪНМЦСПЪ§жЎБШЃЌЮЊе§ЗДгІЫйТЪжЎБШЃЌv(CO)=v(CO2)ВЛФмЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЙЪBДэЮѓЃЛCЃЎЗДгІЧАКѓЦјЬхЮяжЪЕФСПБфЛЏЃЌЬхЯЕЕФбЙЧПБЃГжВЛБфЫЕУїЗДгІДяЕНЦНКтзДЬЌЃЌЙЪCе§ШЗЃЛDЃЎИїЮяжЪЕФХЈЖШБЃГжВЛБфЪЧЦНКтБъжОЃЌЙЪDе§ШЗЃЛЙЪД№АИЮЊBЃЛ
(2)ЂйC(s)+2NO(g)N2(g)+CO2(g)ЁїHЃО0ЃЌЙЬЬхВЛаДШыЦНКтГЃЪ§БэДяЪНЃЌЦНКтГЃЪ§K=![]() ЃЛ
ЃЛ
ЂкИљОнБэжаЪ§жЕжЊЃЌNOЁЂЖўбѕЛЏЬМЕФХЈЖШМѕаЁЃЌЕЊЦјЕФХЈЖШдіДѓЃЌЫЕУїИФБфЬѕМўЪЧЗжРыГіЖўбѕЛЏЬМЮяжЪЃЌЗДгІЪЧЮќШШЗДгІЃЌЩ§ЮТЦНКте§ЯђНјааЃЌвЛбѕЛЏЕЊХЈЖШМѕаЁЃЛ
ЂлДг0ЁЋ20minФкЃЌNOЕФЦНОљЗДгІЫйТЪv=![]() =0.003mol/LminЃЛ
=0.003mol/LminЃЛ
(3)ЗДгІЧАКѓЦјЬхзмжЪСПВЛБфЃЌЭЌЮТЁЂЭЌбЙЯТЃЌДяЕНЦНКтЪБЃЌЦјЬхУмЖШдіДѓЃЌМДЦјЬхЬхЛ§ЫѕаЁЃЛЦНКтЪБЛьКЯЦјЬхУмЖШЪЧЭЌЮТЭЌбЙЯТЦ№ЪМЪБЕФ1.6БЖЃЌдђзмЮяжЪЕФСПБфЮЊдЯШЕФ0.625БЖЃЌзмЮяжЪЕФСП=8ЁС0.625=5molЃЌЗДгІЧАКѓМѕЩйСЫ3molЃЌЫЕУїПЊЪМЯђе§ЗДгІНјааЃЌv(е§)ЃОv(Фц)ЁЃ


 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№ЪіВЛе§ШЗЕФЪЧЃЈ ЃЉ
A.гы28 gCOОпгаЯрЭЌЗжзгЪ§ЕФC2H4ЕФжЪСПвЛЖЈЪЧ28 g
B.1 molAl 3+КЌгаЕФКЫЭтЕчзгЪ§ЮЊ3NA
C.ГЃЮТГЃбЙЯТЃЌ1 molМзЭщКЌгаЕФдзгЪ§ЮЊ5NA
D.ГЃЮТГЃбЙЯТЃЌ1 molLЧтЦјЕФЬхЛ§Дѓгк22.4 L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДгФГаЉаджЪПДЃЌNH3КЭH2OЃЌNH4 +КЭH3O+ЃЌOH-КЭNH2-ЃЌN3ЁЊКЭO2ЁЊСНСНЯрЫЦЃЌОнДЫХаЖЯЯТСаЗДгІЪНжаВЛе§ШЗЕФЪЧ
A. 2Na+2NH3===2NaNH2+H2Ёќ
B. 3CaO+4NH4Cl===Ca3N2+2NH3Ёќ+3H2O+4HCl
C. 3Mg(NH2)2![]() Mg3N2+4NH3Ёќ
Mg3N2+4NH3Ёќ
D. NH4Cl+NaNH2===NaCl+2NH3Ёќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђFeBr2ЁЂFeI2ЕФЛьКЯШмвКжаЭЈШыЪЪСПТШЦјЃЌШмвКжаФГаЉРызгЕФЮяжЪЕФСПБфЛЏШчЭМЫљЪОЃЌЯТСагаЙиЫЕЗЈжаВЛе§ШЗЕФЪЧ
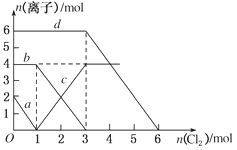
AЃЎdЧњЯпДњБэШмвКжаBrЃБфЛЏЧщПі
BЃЎдШмвКжаFeI2ЕФЮяжЪЕФСПЮЊ2 mol
CЃЎдШмвКжаn(Fe2ЃЋ):n(BrЃ)ЃН2:3
DЃЎЕБЭЈШы2 mol Cl2ЪБЃЌШмвКжаРызгЗДгІЮЊ2Fe2ЃЋЃЋ2IЃЃЋ2Cl2===2Fe3ЃЋЃЋI2ЃЋ4ClЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПTЁЂWЁЂXЁЂYЁЂZЪЧдЊЫижмЦкБэЧАЫФжмЦкжаЕФГЃМћдЊЫиЃЌдзгађЪ§вРДЮдіДѓЃЌЯрЙиаХЯЂШчЯТБэЁЃ
дЊЫї | ЯрЙиаХЯЂ |
T | TдЊЫиПЩаЮГЩздШЛНчгВЖШзюДѓЕФЕЅжЪ |
W | WгыTЭЌжмЦкЃЌКЫЭтгавЛИіЮДГЩЖдЕчзг |
X | XдзгЕФЕквЛРыФмжСЕкЫФЕчРыФмЗжБ№I1=578 kJ/molЃЛ I2= l817 kJ/molЃЛ I3=2745 kJ/molЃЛI4=11575kJ/mol |
Y | ГЃЮТГЃбЙЯТЃЌYЕЅжЪЪЧЙЬЬхЃЌЦфбѕЛЏЮяЪЧаЮГЩЫсгъЕФжївЊЮяжЪ |
Z | ZЕФвЛжжЭЌЮЛЫиЕФжЪСПЪ§ЮЊ63ЃЌжазгЪ§ЮЊ34 |
ЃЈ1ЃЉTY2ЕФНсЙЙЪНЪЧ__________ЪЧ__________(ЬюЁАМЋадЗжзгЁБЛђЁАЗЧМЋадЗжзгЁБЃЉЃЌ1molИУЗжзгжаДцдк________ИіІвМќЁЃ

ЃЈ2ЃЉЛљЬЌYдзгжаЃЌЕчзгеМОнЕФзюИпФмВуЗћКХЮЊ__________ЃЌИУФмВуОпгаЕФдзгЙьЕРЪ§ЮЊ_____________ЁЂЕчзгЪ§ЮЊ_________ЁЃYЁЂбѕЁЂWдЊЫиЕФЕчИКадгЩДѓЕНаЁЕФЫГађЮЊ_________(гУдЊЫиЗћКХзїД№)ЁЃ
ЃЈ3ЃЉвбжЊZЕФОЇАћНсЙЙШчЭМЫљЪОЃЌгжжЊZЕФУмЖШЮЊa g/cm3ЃЌдђZ ЕФАыОЖЮЊ___________pmЃЛZYO4ГЃзїЕчЖЦвКЃЌЦфжаYO42-ЕФЕШЕчзгЬхЪЧ__________ЃЌЦфжаYдзгЕФдгЛЏЙьЕРРраЭЪЧ___________ЁЃдЊЫиZгыШЫЬхЗжУкЮяжаЕФбЮЫсвдМАПеЦјЗДгІПЩЩњГЩГЌбѕЫсЃКZ +HCl+O2=ZC1+HO2ЃЌHO2(ГЌбѕЫс)ВЛНіЪЧвЛжжШѕЫсЖјЧввВЪЧвЛжжздгЩЛљЃЌОпгаМЋИпЕФЛюадЁЃЯТСаЫЕЗЈЛђБэЪОе§ШЗЕФЪЧ___________ЁЃ
AЃЎO2ЪЧбѕЛЏМС BЃЎHO2ЪЧбѕЛЏВњЮя
CЃЎHO2дкМюжаФмЮШЖЈДцдк DЃЎ1 mol ZВЮМгЗДгІга1 molЕчзгЗЂЩњзЊвЦ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЦјЬхЛсдьГЩЫсгъЕФЪЧ
A. CO2 B. SO2 C. N2 D. CO
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛиД№ЯТСаЮЪЬт
ЃЈ1ЃЉЯрЭЌЬѕМўЯТЃЌФГШнЦїЙВЪеМЏЕН1ЬхЛ§CO2ЁЂ3ЬхЛ§H2 ЃЌ ИУШнЦїжаCO2ЁЂH2ЕФЮяжЪЕФСПжЎБШЪЧЃЛШєИУШнЦїЪеМЏЕФCO2ЁЂH2СНжжЦјЬхЫљКЌЗжзгЪ§ЯрЕШЃЌдђCO2ЁЂH2ЕФжЪСПжЎБШЪЧ ЃЎ
ЃЈ2ЃЉ44g MКЭ49g NЧЁКУЭъШЋЗДгІЩњГЩ76g BКЭвЛЖЈСПЕФЦјЬхFЃЎШєFЕФЯрЖдЗжзгжЪСПЮЊ34ЃЌдђБъзМзДПіЯТFЕФЬхЛ§ЮЊ ЃЎ
ЃЈ3ЃЉвбжЊAЪЧЖўМлН№ЪєЃЌ82gИУН№ЪєЕФЯѕЫсбЮжаКЌга6.02ЁС1023ИіЯѕЫсИљРызгЃЌдђИУЯѕЫсбЮЕФФІЖћжЪСПЮЊ ЃЎ
ЃЈ4ЃЉНЋ5mol/LЕФMgЃЈNO3ЃЉ2ШмвКa mLЯЁЪЭжСb mLЃЌЯЁЪЭКѓШмвКжаNO3ЉЕФЮяжЪЕФСПХЈЖШЪЧ ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБфЛЏВЛЪєгкЛЏбЇБфЛЏЕФЪЧ ЃЈ ЃЉ
AЃЎSO2ЪЙЦЗКьШмвКЭЪЩЋ BЃЎТШЫЎЪЙгаЩЋВМЬѕЭЪЩЋ
CЃЎЛюадЬПЪЙКьФЋЫЎЭЪЩЋ DЃЎH2O2ЫЎШмвКЪЙШОСЯЭЪЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУДПОЛЕФCaCO3гы100 mLЯЁбЮЫсЗДгІжЦШЁCO2ЃЌЪЕбщЙ§ГЬМЧТМШчЭМЫљЪО(CO2ЕФЬхЛ§вбелЫуЮЊБъзМзДПіЯТЕФЬхЛ§)ЃЌЯТСаЗжЮіе§ШЗЕФЪЧЃЈ ЃЉ

AЃЎOEЖЮБэЪОЕФЦНОљЫйТЪзюПь
BЃЎEFЖЮЃЌгУбЮЫсБэЪОИУЗДгІЕФЦНОљЗДгІЫйТЪЮЊ0.4 molЁЄLЃ1ЁЄminЃ1
CЃЎOEЁЂEFЁЂFGШ§ЖЮжаЃЌИУЗДгІгУЖўбѕЛЏЬМБэЪОЕФЦНОљЗДгІЫйТЪжЎБШЮЊ2ЁУ6ЁУ7
DЃЎFЕуЪеМЏЕНЕФCO2ЕФСПзюЖр
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com