
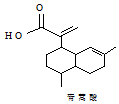
| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与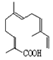 互为同分异构体 互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
分析 A.根据结构简式确定分子式;
B.该分子中只有碳碳双键能和氢气发生加成反应;
C.青蒿酸的不饱和度是5, 的不饱和度是5,且二者分子式相同;
的不饱和度是5,且二者分子式相同;
D.苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体,苯环上醛基与羟基处在对位,同分异构体有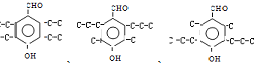 3种.
3种.
解答 解:A.由结构简式可知青蒿酸的分子式为C15H22O2,故A错误;
B.只有2个碳碳双键与氢气发生加成反应,则1 mol青蒿酸可与2 mol H2发生加成反应,故B错误;
C.青蒿酸的不饱和度是5, 的不饱和度是5,且二者分子式相同,结构不同,所以为同分异构体,故C正确;
的不饱和度是5,且二者分子式相同,结构不同,所以为同分异构体,故C正确;
D.苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体,苯环上醛基与羟基处在对位,同分异构体有 3种,故D错误.
3种,故D错误.
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及知识运用能力,明确官能团及其性质关系、同分异构体概念是解本题关键,注意D选项中限制性同分异构体种类判断方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
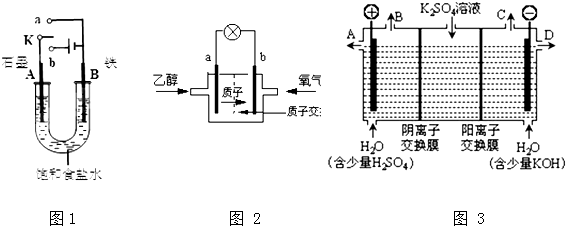
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
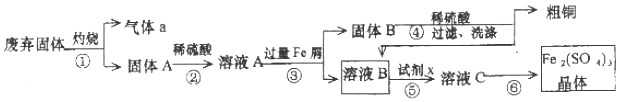
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.4 mol/L HB溶液和 0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
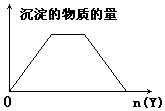
| A. | 向NaOH和Ca(OH)2的混合液中通入CO2 | |
| B. | 向HCl和AlCl3的混合液中滴加NaOH | |
| C. | 向NH4Cl和AlCl3的混合液中滴加NaOH | |
| D. | 向含NaOH的NaAlO2溶液中滴加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com