
分析 根据澄清溶液得,原溶液没有相互反应的离子;根据实验①现象排除与强酸反应的离子;根据实验②现象排除与NaOH反应的离子;根据实验③现象判断存在的离子,排除与该离子反应的离子.
解答 解:由“澄清溶液得”得,原溶液没有相互反应的离子;由实验①的现象判断,排除与强酸反应的CO32-离子存在,原溶液呈强酸性,一定含有H+,所以阴离子可能是Cl-或SO42-或Cl-和SO42;由实验②的现象判断,排除与NaOH反应的Mg2+存在;根据实验③现象判断,原溶液中含有Ba2+,不含与Ba2+反应的SO42;所以原溶液中存在的阴离子是Cl-,通过以上现象不能判断原溶液中是否含有Na+.
综上得到:该溶液中肯定存在的离子有H+、Ba2+、Cl-,肯定不存在的离子有Mg2+、SO42-、CO32-,不能判断原溶液中是否含有Na+.
故答案为:H+、Ba2+、Cl-;Mg2+、SO42-、CO32-;Na+.
点评 本题是一道关于离子反应的应用知识的考查题,注意学会判断溶液中离子能否共存的规律以及离子反应的现象确定是关键,难度中等.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 含有大量H+的溶液中:Na+、Fe2+、NO3-、SO42- | |
| C. | 某无色溶液中:Na+、Al3+、Cl-、HCO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol•L-1的无色溶液中:K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-2c}{a}$ mol/L | B. | $\frac{2b-4c}{a}$mol/L | C. | $\frac{4c-2b}{a}$ mol/L | D. | $\frac{b-4c}{a}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
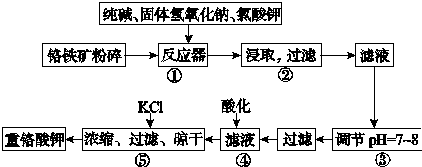
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
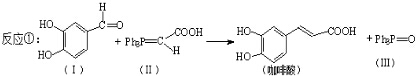
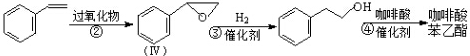
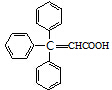 ;咖啡酸苯乙酯的键线式结构简式为
;咖啡酸苯乙酯的键线式结构简式为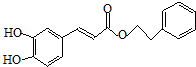 .
.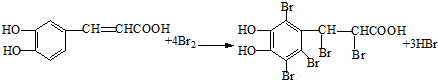 .
.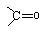
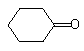 的芳香化合物共有3种
的芳香化合物共有3种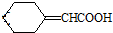 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
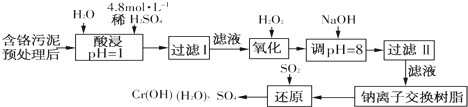
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com