
铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2
+2Ni(OH)2下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
某化学兴趣小组的同学设计了如图所示的实验装置,该装置的塑料隔板(有许多细小的孔)插入的深度以钠恰好与水接触为准,反应产生的气体将钠托起进入煤油中,反应随即停止。当钠表面的气泡消失后,钠块又下沉到水与煤油的界面上。即使钠块较大,也可防止反应太剧烈。
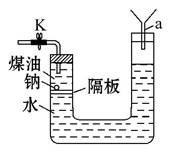
(1)实验之前必须进行的操作是_ ______________,操作方法是 ___________
_________________________________________。
(2)在反应过程中关闭K,能观察到的现象为 ____________________________
___________________________________________________________________。
(3)U形管右端仪器a的作用是 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁棒和石墨棒用导线连接后,浸入0. 01mol/L 的氯化钠溶液中,下列说法正确的是
A.铁棒附近产生OH— B.铁棒质量减少
C.石墨棒上放出氢气 D.石墨棒上放出氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
能源短缺是人类社会面临的重大
问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
则CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=
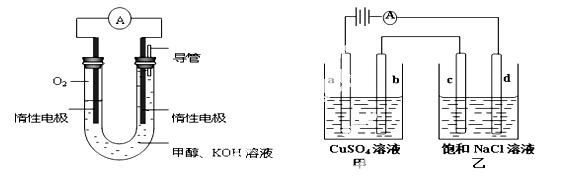
(3)某实验小组依据甲醇燃烧的反应原理,设计如下左图所示的电池装置。
① 该电池负极的电极反应为 。
② 工作一段时间后,测得溶液的pH (填增大、不变、减小)。
③用该电池作电源,组成如下右图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应 ,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为 mL(标准状况) ,电解后向甲中加入适量下列某一种物质 ,可以使溶液恢复到原来状态,该物质是 (填写编号) 。
A.CuO B.CuCO3 C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl -KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl
-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl 2+Li2SO4+Pb。
2+Li2SO4+Pb。
下列有关说法正确的是
A.正极反应式:Ca +  2Cl--2e- = CaCl2
2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.没转移0.1mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
为检验某溴代烃(R-Br)中的溴元素,有下列实验操作:
①加热煮沸 ②加入AgNO3溶液 ③取少量卤代烃 ④加入稀硝酸酸化 ⑤加入NaOH溶液 ⑥冷却,正确 操作的先后顺序是 ( )
操作的先后顺序是 ( )
A. ③①⑤⑥②④ B.③①②⑥④⑤
③①⑤⑥②④ B.③①②⑥④⑤
C.③⑤①⑥④② D.③⑤①⑥②④
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO
气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2.则下列说法中正确的是 ( )
A.通CO的一极是电池的正极
B.负极发生的电极反应是:O2+2CO2+4e-===2CO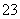
C.负极发生的电极反应是:CO+CO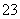 -2e-===2CO2
-2e-===2CO2
D.正极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙
述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
A.碱性:KOH>NaOH  B.相对分子质量:Ar>K
B.相对分子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com