
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将某气体通入品红溶液中,溶液褪色 | 该气体中有SO2 |
| B | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| C | 下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,再将上层液体从下端管口放出 | 取出分液漏斗中的上层液体 |
| D | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 说明该溶液中一定含有Fe2+ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.用湿润的pH试纸测定稀盐酸的pH |
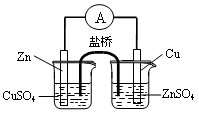
| B.用下图1构成锌—铜原电池 |
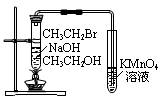
| C.用下图2根据有关实验现象推知酸性:CH3COOH>H2CO3>C6H5OH |
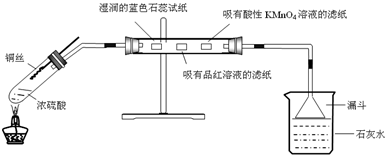
| D.用下图3验证溴乙烷发生消去反应生成烯烃 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 析,写出了以下四个关系式。请你判断:在正确的关系式后面打“
析,写出了以下四个关系式。请你判断:在正确的关系式后面打“ ”,在错误的后面写出正确的关系式。
”,在错误的后面写出正确的关系式。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
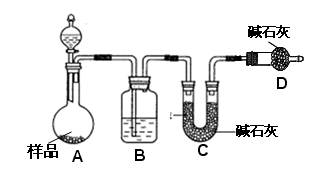
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2HCrO
2HCrO Cr2O+H2O,由此判断该滴定适宜的pH值范围可能是 。(填代号)
Cr2O+H2O,由此判断该滴定适宜的pH值范围可能是 。(填代号)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
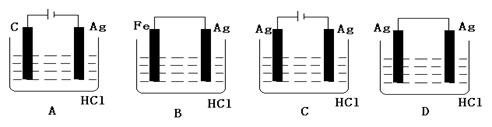
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.蒸发操作中,应使混合物中的水未完全蒸干时,就停止加热 |
| B.将饱和FeCl3溶液滴入煮沸的NaOH溶液中,从而制得Fe(OH)3胶体 |
| C.过滤操作不能用来分离胶体和溶液 |
| D.开始蒸馏时,应该先加热蒸馏烧瓶,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com