
科目:高中化学 来源: 题型:
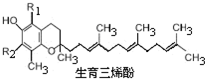 (2010?江苏一模)α,β,γ和δ四种生育三烯酚是构成维生素E的主要物质,下列叙述中不正确的是( ) (2010?江苏一模)α,β,γ和δ四种生育三烯酚是构成维生素E的主要物质,下列叙述中不正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
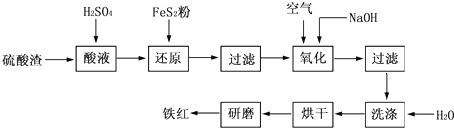
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
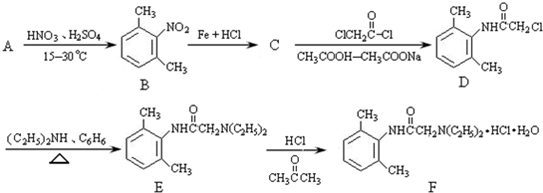
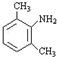

 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式:

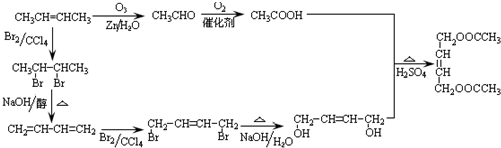

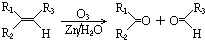
| 浓硫酸 |
| 170° |
| 高温高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
(2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.| 元素 | Mn | Fe | |
| 电离能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
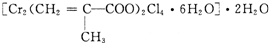
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
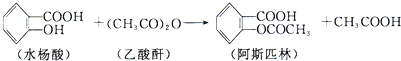
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com