
【题目】常温下,用0.10mol·L-1KOH溶液滴定10.00mL0.10mol·L-1H2C2O4(二元弱酸)溶,所得滴定曲线如图所示(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是( )
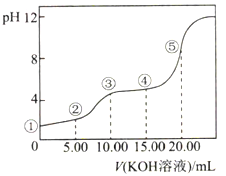
A. 点①所示溶液中:c(H+)/c(OH-)=1012
B. 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C. 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+ c(C2O42-)=0.10mol·L-1
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
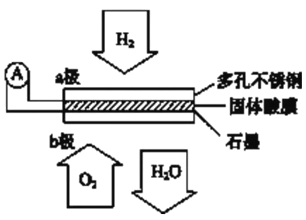
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含Cl-、SO42-、CO32-、Cu2+、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液 100mL 进行以下实验:(填写下表空格)
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量NaOH溶液,得到蓝色沉淀; | 肯定有 Cu2+、肯定无__________。 | 肯定无该离子的理由_____。 |
步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到24.0g 固体; | Cu2+物质的量浓度为_____________mol/L | Cu 元素守恒。过滤所用玻璃仪器有烧杯、 ___________________ |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀。 | 肯定有Cl-、________; 肯定无Ba2+。 | 相应的离子方程式:___________________________ ,肯定有 Cl-的理由______________ |
若 100mL 溶液中含有 0.3mol Na+,则向步骤三的滤液中加入足量 AgNO3 溶液, 过滤、洗涤、干燥,可得到______________g 白色沉淀[保留小数点后一位]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
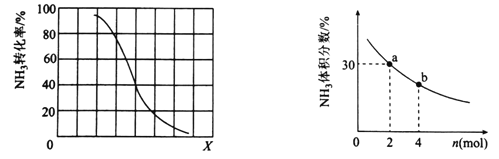
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
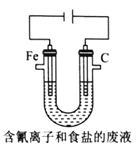
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置测定空气中SO2的含量,A溶液最好选用
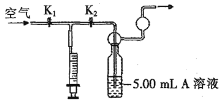
A.NaOH溶液(滴有2-3滴酚酞溶液)
B.KMnO4溶液(滴有-定量硫酸溶液)
C.HNO3溶液(滴有2-3滴Ba(NO3)2溶液)
D.I2溶液(滴有2-3滴淀粉溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
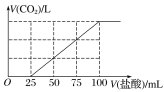
A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种化合物,各取40g相混合,完全反应后,容器中只有18gB、49gC,还有D生成,已知D的相对分子质量为106。下列说法中不正确的是( )
A.化学方程式一定是A+B=C+D
B.生成D的物质的量为0.5mol
C.若化学方程式为2A+B=C+D,则A的摩尔质量为40g·mol-1
D.若D是碳酸钠,则钠离子的质量为23g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
A.v(A)=0.15 mol·L-1·min-1
B.v(B)=0.015 mol·L-1·s-1
C.v(C)=0.40 mol·L-1·min-1
D.v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com