
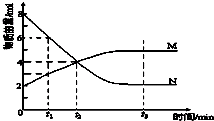
 一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )| A、反应的化学方程式:2M?N |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率为75% |
| D、若t1=2min,用N的浓度表示的化学反应速率为0.5 mol?(L?s)-1 |
| (8-2)mol |
| 8mol |
| (8-6)mol |
| 2L |
| △c(N) |
| △t |
| 1mol/L |
| 2min |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、卤素单质与水反应均可用X2+H2O=HXO+HX表示 |
| B、HX都极易溶于水,它们的热稳定性随X的核电荷数的增加而减小 |
| C、卤素单质的颜色由F2→I2按相对分子质量增大而变深 |
| D、X-的还原性依次为:F-<Cl-<Br-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
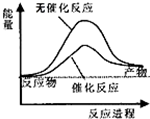
| A、如图可表示水分解过程中的能量变化 |
| B、高温高压下的超临界水,溶液中的氢离子和氢氧根离子浓度较大,有时显酸性,有时显碱性 |
| C、需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D、等体积、等浓度的醋酸钠溶液和次氯酸钠溶液中,所含离子总数,前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、随着核电荷数的增加,单质与水反应的剧烈程度增大 |
| B、随着核电荷数增加,单质的熔点.沸点升高 |
| C、随着核电荷数增加,它们的密度逐渐减小 |
| D、随着核电荷数增加,离子的氧化性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
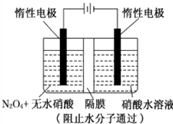 如图所示装置可通过发生“3N2O4+8HNO3=6N2O5+2NO+4H2O”制备N2O5,有关说法中错误的是( )
如图所示装置可通过发生“3N2O4+8HNO3=6N2O5+2NO+4H2O”制备N2O5,有关说法中错误的是( )| A、阴极的电极反应为:NO3-+4H++3e-=NO↑+2H2O |
| B、阳极的电极反应为:N2O4+2 HNO3-2e-=2N2O5+2H+ |
| C、当电路中通过6 mol e-时整个电解池中参与反应的HNO3为8mol |
| D、当电路中通过6 mol e-时,有8molH+从阳极向阴极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸、碱和盐类都属于电解质,其他化合物都是非电解质 |
| B、强电解质与弱电解质的本质区别,是其水溶液导电性的减弱 |
| C、电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离 |
| D、常见的强酸、强碱和大部分盐都是强电解质,其他化合 物都是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com