
【题目】在体积都为1 L,pH 都等于2 的盐酸和醋酸溶液中,投入0.65 g 锌粒,则下图所示比较符合客观事实的是
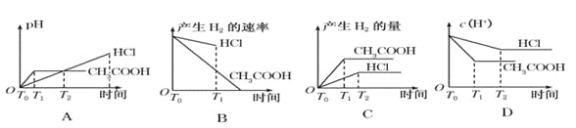
A. A B. B C. C D. D
【答案】C
【解析】试题分析:体积都为1L,pH都等于2的盐酸和醋酸溶液中,n(CH3COOH)>n(HCl)=0.01mol,0.65g锌粒的物质的量=0.65g÷65g/mol=0.01mol,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol,醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快;反应后,醋酸有剩余,导致醋酸溶液中pH小于盐酸溶液中;A.产生氢气的量从0开始逐渐增多,最终由于醋酸电离平衡的存在,生成氢气的量比盐酸多,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,和同量锌反应速率快,故图像不符合题意,A错误;B.反应开始氢离子浓度相同,反应速率相同.曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,所以图像不符合题意,B错误;C.刚开始时,溶液的pH值为2,由于醋酸电离平衡的存在,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,所以醋酸反应速率始终大于盐酸反应速率,反应后,醋酸有剩余,所以生成的氢气的量比盐酸多,C正确;D.反应开始氢离子浓度相同,反应过程中醋酸存在电离平衡,醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,D错误;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如图:
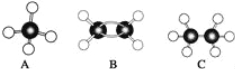
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是 (填对应字母,下同)。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是 。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是 。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
PET是世界上产量最大的合成纤维,其结构简式为:
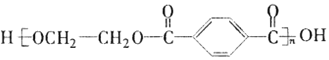
现以煤的干馏产品A与F为原料制备PET,生产的工艺流程如图所示。
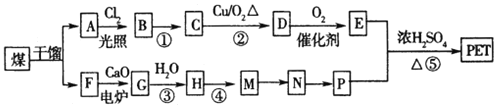
其中A为烃,含碳元素的质最分数为90.6%,其蒸气密度是空气密度的3.66倍,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。M分子里所有原子共平面。
请回答下列问题:
(1)A的名称为______。M→N的反应类型为______ ;
(2)反应①的反应条件为:______;
(3)写出有机物A所有一氯代物的结构简式:______。
(4)写出下列反应的化学方程式:
反应②:_________;反应③:_________。D与足量的氢氧化铜悬浊液煮沸:_________;
反应⑤:_________。
(5)P的一种同系物X的分子式为C3H8O2,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2:l : l 。则X的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30ml 0.5mol/L NaOH溶液稀释到500ml,稀释后取出5ml,则溶液中NaOH的物质的量浓度为 ( )
A. 0.03mol/L B. 0.3mol/L C. 0.05mol/L D. 0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组的比较中,前者比后者大的是
A.同温度、同浓度的NaCl溶液和氨水的导电能力
B.25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
D.25℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制高能量电池,已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )
A.电解法
B.热还原法
C.热分解法
D.铅热法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
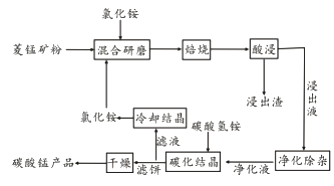
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为____________________。
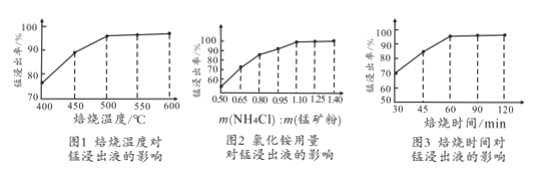
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________、_______________、______________。
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________。
(5)上述流程中可循环使用的物质是_______________。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________(还原产物是Cr3+。
②产品中碳酸锰的质量分数为_____________(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

请回答下列问题:
(1)A是一种能与溴水反应使其褪色的芳香烃,其结构简式为 。
(2)在上述合成路线发生的反应中属于取代反应的是 (填反应编号)。
(3)反应①发生时若不加入H2O2,会生成较多的一种副产物。写出这种副产物的结构简式 。
(4)写出由C→D 、 E→F转化的化学反应方程式 、 。
(5)在化合物E多种同分异构体中,只含有一种含氧官能团,且能与FeCl3溶液发生显色反应的同分异构体有 种(不考虑羟基与碳碳双键直接连在一起的同分异构体),任写一种满足上述条件且核磁共振氢谱中有5个峰信号的同分异构体的结构简式 。
(6)按上述合成路线的表达形式,写出由![]() 制备
制备![]() 的合成路线。
的合成路线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com