
| A. | 在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
分析 任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断离子浓度大小或离子浓度之间关系,据此分析解答.
解答 解:A.氯化铵是强酸弱碱盐,铵根离子水解生成一水合氨,根据物料守恒得c(Cl-)=c(NH4+)+c(NH3•H2O),故A正确;
B.碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解和电离,但溶液中仍然存在物料守恒,根据物料守恒得c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B正确;
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合,溶液中溶质为等物质的量浓度的NaCl、NaHA、NaA,溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故C错误;
D.硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,所以c(H+)>c(OH-),结合电荷守恒得c(NH4+)>c(SO42-),但其水解程度较小,所以离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D错误;
故选AB.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,知道荷守恒和物料守恒的正确运用,强酸弱碱盐或强碱弱酸盐能发生水解但程度较小,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 步骤2是放热反应 | B. | 三个状态的能量E2最大 | ||
| C. | 要实现步骤1的转化,必须加热 | D. | 该反应放出的热量为E1一E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
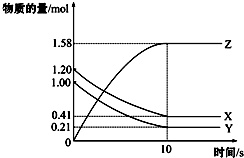 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79 mol/L | |
| C. | 反应开始到10 s时,Y的转化率为79.0% | |
| D. | 在前10 s内用X、Y、Z表示的反应速率数值相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族的元素都是碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 原子序数为16的元素位于元素周期表的第3周期VIA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 第二周期中形成化合物最最多的元素 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期中可以作为半导体材料的元素 |
| E | 第四周期中最外层只有一个电子且内层完全排满电子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L | |
| B. | 常温时将pH=3的醋酸和pH=ll的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c( SO42-)+C( HCO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com