
将等体积的0.1 mol·L-1 KHSO4溶液逐滴加入0.1 mol·L-1的Na2SO3溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中不正确的是
| A.c(SO)>c(SO)>c(H+)>c(OH-) |
| B.c(Na+)>c(K+)>c(H+)>c(OH-) |
| C.c(Na+)=c(SO)+c(H2SO3)+c(HSO)+c(SO) |
| D.c(Na+)+c(K+)+c(H+)=2c(SO)+c(HSO)+c(OH-) +2c(SO) |
科目:高中化学 来源: 题型:阅读理解
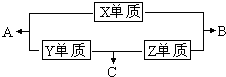 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
| ||
| △ |
| ||
| △ |
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2015届广东省高一上期末考试化学试卷(解析版) 题型:填空题
请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为 ,质量之比为 。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为 g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol—1 ,则:
①该气体的物质的量为 mol。
②该气体在标准状况下的体积为 L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为 mol·L—1。
(4)将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是 mol·L—1。
(5)用等体积的0.1 mol·L—1的BaCl2 溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2 三种溶液中的SO42—完全沉淀,则三种硫酸盐的物质的量浓度之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com