
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ①②④ |
分析 ①铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液中通入二氧化碳生成氢氧化铝;
②SiO2与氢氧化钠反应生成Na2SiO3和水,Na2SiO3与氯化氢反应生成H2SiO3;
③电解氯化镁溶液得到的是氢气、氯气和氢氧化镁;
④钠和氧气在加热条件下生成淡黄色的过氧化钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气.
解答 解:①铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液中通入二氧化碳生成氢氧化铝和碳酸氢钠,故①正确;
②SiO2与氢氧化钠反应生成Na2SiO3和水,Na2SiO3与氯化氢反应生成H2SiO3和氯化钠,转化能由一步反应实现,故②正确;
③电解氯化镁溶液得到的是氢气、氯气和氢氧化镁,不能得到镁,故③错误;
④钠和氧气在加热条件下生成淡黄色的过氧化钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,故④正确.
故选D.
点评 本题综合考查化合物的性质,为高考常见题型,题目难度不大,熟练掌握物质的性质是解决此类问题的关键,正确运用物质分类及反应规律则是解决此类问题的有效方法.


科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是最早使用的半导体材料 | B. | 盛NaOH溶液的试剂瓶塞可用玻璃塞 | ||
| C. | 水泥、玻璃、水晶都是硅酸盐制品 | D. | 自然界中没有单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
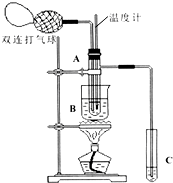 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
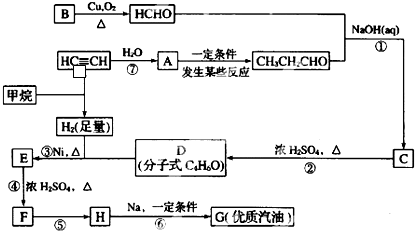
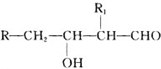
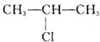
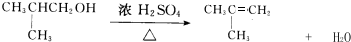 ;H→G
;H→G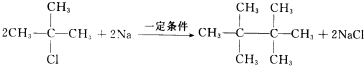 .
.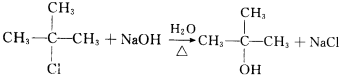 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
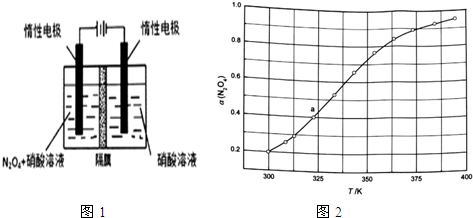
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com