
����Ŀ����֪25��ʱ�й�����ĵ���ƽ�ⳣ����
���ữѧʽ | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ����25�棩 | 1.8��10��5 | 4.9��10��10 | K1=4.3��10��7 |
�������й�˵����ȷ���ǣ� ��
A.�����ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH��NaCN����pH��Ma2CO3����pH��CH3COONa��
B.amol/L HCN ��Һ��b mol/L NaOH��Һ�������Ϻ�������Һ��c��Na+����c��CN��������һ��a����b
C.����������μ�ˮ������Һ�ĵ����ԡ�����ĵ��루�̣��ȡ�c��H+������������С
D.NaHCO3��Na2CO3�Ļ����Һ�У�һ�����ڣ�c��Na+��+c��H+��=c��OH����+c��HCO3����+2c��CO ![]() ��
��
���𰸡�D
���������⣺A����ĵ��볣��Խ���������Խǿ�����ε�ˮ��̶�ԽС������Һ��pHԽС�����ԣ�CH3COOH��HCN��CO ![]() ���������ε�ˮ��̶ȣ�Na2CO3��NaCN��CH3COOH��������ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH��Na2CO3����pH��NaCN����pH��CH3COONa������A����
���������ε�ˮ��̶ȣ�Na2CO3��NaCN��CH3COOH��������ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH��Na2CO3����pH��NaCN����pH��CH3COONa������A����
B���� HCN ��NaOH�����ʵ�����Ӧʱ������NaCN��NaCN��Һ��c��Na+����c��CN����������a��һ������b����B����
C������������μ�ˮ������ĵ���̶�������Һ�ĵ����ԡ�c��H+������������С����C����
D��NaHCO3��Na2CO3�Ļ����Һ�У�һ�����ڵ���غ㣬����c��Na+��+c��H+��=c��OH����+c��HCO ![]() ��+2c��CO
��+2c��CO ![]() ������D��ȷ��
������D��ȷ��
��ѡD��


 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��.�û�ѧ����ش��������⣺
��1��д��������̼���ӵĵ���ʽ��___________��
��2��д���������ӵĽṹʽ___________��
��3��A+��B����C��D ��������(���ӻ�����)�����Ƕ��ֱ�10�����ӣ���֪����������ת����ϵ��A++B��![]() C+D������A+�ĵ���ʽ��_____________���Ƚ�C��D���ȶ��Ե�ǿ����_____________________���û�ѧʽ��ʾ����
C+D������A+�ĵ���ʽ��_____________���Ƚ�C��D���ȶ��Ե�ǿ����_____________________���û�ѧʽ��ʾ����
��4���õ���ʽ��ʾMgCl2���γɹ���__________________________________��
��.�������ʣ��� N2 �� CO2 �� NH3 �� Na2O ��Na2O2 �� NaOH �� CaBr2 �� H2O2 �� NH4Cl �� Ar��
��1���Ⱥ��м��Լ��ֺ��зǼ��Լ�����_______��������ţ���ͬ��
��2�����зǼ��Լ������ӻ�������_____��
��3��������ѧ������_____��
�����б仯�У��� �ɱ������� �� ������ۻ��� �� KHSO4���ڣ� �� ��������ˮ��
�� ��������ˮ���� HI�ֽ⣻ �� �������� �� ��������ľ̿������
��1��δ�ƻ���ѧ������___________��
��2�������Ӽ����ƻ�����_________��
��3�������ۼ����ƻ�����_________��
��.�������ʣ��� 1H��2H��3H �� �� H2O��D2O��T2O�� �� O2��O3�� �� 14N��14C
��1����Ϊͬλ�ص��ǣ�______��
��2����Ϊͬ����������ǣ�______��
��3���������ԭ��1H��2H��3H ���ȵ�����ԭ��35Cl��37Cl����Ϊ�Ȼ��⣬�ɵ÷�������Է���������ͬ����________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ������ȡ������ʵ��װ����ͼ��ʾ����ش���
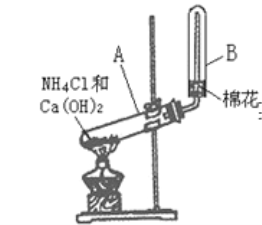
��1����ͬѧ��ʵ��װ������һ�����ԵĴ�����____��
��2��ʵ�����ư����Ļ�ѧ����ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ѻ������̬N4���ӣ���ṹΪ��������(��ͼ��ʾ)����֪����1 mol N��N����167 kJ����������1 mol N��N����942 kJ����������˵����ȷ����

A. N4����һ�����͵Ļ�����
B. N4(g)=4N(g)�Ĺ������ͷ�1002 kJ����
C. 1 mol N4ת��ΪN2ʱҪ����882 kJ����
D. N4��N2��Ϊͬ�������壬N4ת��ΪN2���ڻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��AgBr����ˮ�в��ܵ��磬��AgBr���ǵ����
B. CO2����ˮ�õ�����Һ�ܵ��磬����CO2�ǵ����
C. ���ڵĽ����ܵ��磬���Խ����ǵ����
D. ��̬��NaCl�����磬�� NaCl�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����мס��ҡ�����������Ԫ�أ���֪����Ԫ���ǵؿ��к�������Ԫ�أ���Ԫ��Ϊ����Ԫ�أ�����ԭ�Ӻ���K��L�������֮�͵���M��N�������֮�ͣ���Ԫ�صĵ��ʼ��仯�������ɫ��Ӧ���Ի�ɫ�������ڶ�Ԫ�صĵ�����ȼ�գ�����ʲ�ɫ����ش��������⡣
��1��д��Ԫ�ط��ţ���_________ ��__________��
��2����������Ԫ�ؿ��γ�ԭ�Ӹ�����Ϊ1:1�Ļ���������ʽΪ___________��
��3�������й����ͬ����Ľ���Ԫ�ص������У��������________����ѡ����ĸ����
A����Ԫ�صĵ�����������ȼ�վ�������Ӧ�Ĺ�������
B������Ӳ������ӣ���Ԫ�ص��ʵ��۷е�����
C����Ԫ�ص��ʾ�����ˮ��Ӧ��������
D����Ԫ�ص��ʾ��ܱ�����ú����
��4���ҺͶ��γɵĻ������������_________������������������������������õ���ʽ��ʾ���γɹ�����____________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A. Na2CO3��Һ�м�����2H��+CO32-=CO2����H2O
B. MgO��ϡ���ᷴӦ��MgO+2H��=Mg2��+H2O
C. AlCl3��Һ�����������������Һ��Ӧ��AlCl3+3OH-=Al (OH)3��+3Cl��
D. пƬ������������Һ�У�Zn+Ag��=Zn2��+Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݽ����˳�����Cu���ܷ������·�Ӧ��Cu+2H2O=Cu��OH��2��+H2������ѡ��ǡ���缫���Ϻ͵��Һ���е�⣬�����Ӧ���ܱ�Ϊ��ʵ���������ֵ缫���Ϻ͵��Һ�У���ʵ�ָ÷�Ӧ��Ϊǡ�����ǣ� ��
A | B | C | D | |
���� | ʯī | Cu | Cu | Cu |
���� | ʯī | ʯī | Fe | Pt |
���Һ | CuSO4��Һ | Na2SO4��Һ | H2SO4��Һ | H2O |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�һ�����ܱ������У����淴ӦA��g��+B��g��xC��g��������ͼ��ʾ�Ĺ�ϵ���ߣ�������ͼ�����ж���ȷ���ǣ� �� 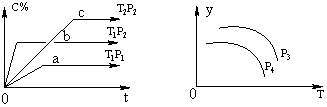
A.p3��p4 �� y���ʾA�����ʵ�������
B.������A��Ũ�ȣ�ƽ����ϵ��ɫ���Cһ��������ɫ������
C.p3��p4 �� y���ʾƽ�ⳣ��K
D.p3��p4 �� y���ʾ��������ƽ��Ħ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com