
| A. | 摩尔是国际单位制中的七大基本物理量之一 | |
| B. | 1 mol任何物质都约含有6.02×1023个原子 | |
| C. | 以克为单位时,2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 | |
| D. | 在同温同压下,气体所占的体积主要由气体分子的物质的量决定 |
分析 A、摩尔是物质的量的单位;
B、物质不一定由原子构成;
C、1mol物质所具有的质量为该物质的摩尔质量;
C、在同温同压下,气体体积V=nVm.
解答 解:A、物质的量是七大基本物理量之一,而摩尔是物质的量的单位,故摩尔是七大基本物理量的单位之一,故A错误;
B、物质不一定由原子构成,还可能由分子或离子构成,故1mol物质中不一定含NA个原子,故B错误;
C、1mol物质所具有的质量为该物质的摩尔质量,故一种物质的摩尔质量的数值为确定的,即以克为单位时,2 mol水的摩尔质量与1 mol水的摩尔质量相等,故C错误;
C、在同温同压下,气体摩尔体积Vm的数值相同,而气体体积V=nVm,故气体的体积取决于气体的物质的量,故D正确.
故选D.
点评 本题考查了物质的量和其单位mol,并应注意物质的摩尔质量的数值和单位,难度不大,应加强基础的掌握.


科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
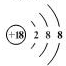 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
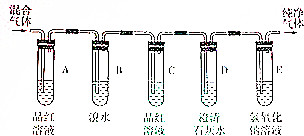 工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯
工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
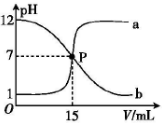
| A. | 盐酸的物质的量浓度与NaOH溶液的物质的量浓度相等 | |
| B. | P点时溶液中c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 | |
| D. | 曲线b中滴定前NaOH溶液的体积为150mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
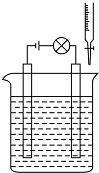 实验探究离子之间是否发生了反应.
实验探究离子之间是否发生了反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.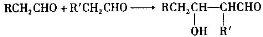

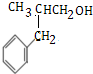 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1摩醋酸(CH3COOH)的质量与NA个醋酸分子的质量相等 | |
| B. | NA个氧分子和NA个氢分子的质量比等于16:1 | |
| C. | 28 g氮气所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积约是11.2 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com