

分析 (1)燃料电池属于原电池,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(3)乙池有外接电源是电解池,阳极上水得电子生成氧气和氢离子,阴极上银离子放电,酸性溶液使紫色石蕊试液变红,根据电极附近溶液的酸碱性变化确定溶液变红的电极;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,据此写出离子方程式.
解答 解:(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动,
故答案为:原电池;CH3OH;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上水得电子生成氧气和氢离子,溶液呈酸性,加热紫色石蕊试液呈红色,电极反应式为4H2O-4e-=O2↑+4H+,
故答案为:A;4H2O-4e-=O2↑+4H+;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O=4Ag+O2↑+4H+,
故答案为:4Ag++2H2O=4Ag+O2↑+4H+.
点评 本题考查了原电池和电解池原理的应用,为高频考点,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )| A. | 改变条件使纯水的pH值减小,其酸性增强 | |
| B. | 100℃时某溶液中由水电离产生的c(H+)=1×10-11 mol•L-1,则该溶液的pH可能是11或3 | |
| C. | 将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1 | |
| D. | 100℃时,pH值均为8的醋酸钠和氨水两溶液中,水的电离程度之比为104:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业是电解熔融的NaCl,阳极产生Cl2 | |
| B. | 氢氧燃料电池可将热能直接转化为电能 | |
| C. | 原电池工作时,电子从负极经外电路移向正极 | |
| D. | 工业上电解熔融的AlCl3来制取铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
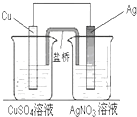 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
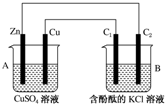 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
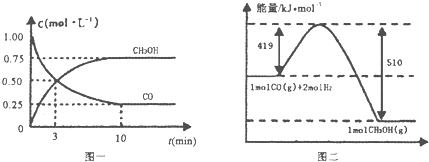
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氦气的摩尔质量是8g•mol-1 | |
| C. | 1molH2SO4中含1molH2 | |
| D. | 1molH2O的质量是18g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com