
【题目】判断正误(在答题卡表格中①~题题号对应位置画“√”或“×”)。
(1)2020年6月23日9时43分北斗系统第五十五颗导航卫星暨北斗三号最后一颗全球组网卫星成功发射!执行本次发射任务的长三乙运载火箭加装的常规燃料为偏二甲肼(C2H8N2)和四氧化二氮。偏二甲肼和四氧化二氮也可以作为燃料电池的两极反应物。二者反应的产物均对环境不产生污染。根据以上信息判断下列说法正误:
①偏二甲肼是有机物,其中氮元素化合价为-3_____
②生成1molCO2转移8mol电子_____
③偏二甲肼与四氧化二氮的反应是放热反应_____
④该燃料电池中偏二甲肼是负极反应物_____
(2)如图所示装置,用生成的氯气与乙二醛制备乙二酸,反应原理为![]() +2Cl2+2H2O→
+2Cl2+2H2O→![]() +4HCl。
+4HCl。
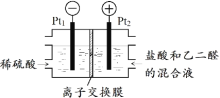
判断以下说法的正误:
⑤该装置利用上述反应将电能全部转化为化学能_____
⑥Pt1电极的反应式为2H2O+2e-=H2↑+2OH-_____
⑦盐酸除增强溶液导电性的作用,还提供Cl-参与电极反应_____
⑧理论上每得到0.1mol乙二酸,将有0.4molH+从右室迁移到左室_____
(3)判断对下列图像的描述的正误:
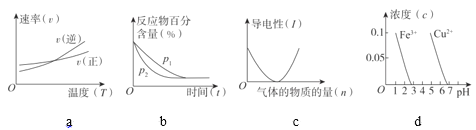
⑨根据图a可判断反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0_____
2AB3(g)的ΔH>0_____
⑩图b可表示压强(P)对反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响_____
3C(g)+D(s)的影响_____
图c可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化_____
根据图d,除去CuSO4溶液中的Fe3+,可加入NaOH调节pH至3~4_____
(4)利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
实验装置 | 实验编号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
| i | H2O | 7 |
|
ii | 1.0mol·L-1NH4Cl | 5 | ||
iii | 0.5mol·L11(NHspan>4)2SO4 | 5 | ||
iv | 1.0mol·L-1NaCl | 7 | ||
v | 0.5mol·L-1Na2SO4 | 7 |
通过以上实验判断下列说法正误:
i与iv、v比较说明盐溶液可以加快吸氧腐蚀速率_____
ii与iii、iv与v比较说明吸氧腐蚀速率与阴离子种类无关_____
向实验v溶液中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快_____
向实验ii溶液中加等体积的0.5mol·L-1(NH4)2SO4,吸氧腐蚀速率一定加快_____
【答案】× √ √ √ × × √ √ × × × √ √ × √ ×
【解析】
根据偏二甲肼的分子结构及相关元素的非金属性的强弱关系判断N元素的化合价,根据氧化还原反应中的电子转移进行相关计算;根据燃料电池的特点及原电池原理分析相关的问题;根据影响化学平衡的因素及平衡移动原理分析相关问题;根据强电解质和弱电解质的电离特点分析溶液导电性的变化;根据控制变量法分析相关的实验数据。
(1)偏二甲肼和四氧化二氮也可以作为燃料电池的两极反应物。二者反应的产物均对环境不产生污染,则反应产物为CO2、N2和H2O,该反应的化学方程式为C2H8N2+2N2O42CO2+3N2+4H2O。
①偏二甲肼(C2H8N2)是有机物,其结构简式为(CH3)2N-NH2),其中两个氮原子之间形成一对共用电子对,该共价键为非极性键,其他的共价键均为极性键,由于在该有机物中N元素的非金属性最强,故其化合价为-2,①不正确,画×;
②C2H8N2+2N2O42CO2+3N2+4H2O,该反应中,N2O4是氧化剂,其中N由+4降低到0,C2H8N2是还原剂,电子转移的数目是16e-,因此生成1molCO2转移8mol电子,②正确,画√;
③偏二甲肼和四氧化二氮也可以作为燃料电池的两极反应物,因此偏二甲肼与四氧化二氮的反应是放热反应,③正确,画√;
④燃料在燃料电池的负极发生氧化反应,所以该燃料电池中偏二甲肼是负极反应物,④正确,画√;
(2)⑤在电解过程中,电能不可能全部转化为化学能,有一部分会转化为热能,故⑤不正确,画×;
⑥Pt1电极为阴极,稀硫酸中的H+放电生成氢气,电极反应式为2H++2e-=H2↑,⑥不正确,画×;
⑦盐酸中的Cl-在阳极上放电生成Cl2,然后氯气把乙二醛氧化为乙二酸,所以,盐酸除增强溶液导电性的作用,还提供Cl-参与电极反应,⑦正确,画√;
⑧阳极区的总反应为![]() -4e-+2H2O→
-4e-+2H2O→![]() +4H+,阴极反应为4H++4e-=2H2↑,所以离子交换膜为阳离子交换膜,理论上每得到0.1mol乙二酸,将有0.4molH+从右室迁移到左室⑧正确,画√;
+4H+,阴极反应为4H++4e-=2H2↑,所以离子交换膜为阳离子交换膜,理论上每得到0.1mol乙二酸,将有0.4molH+从右室迁移到左室⑧正确,画√;
(3)⑨根据图a可知,该反应在图中两线交点处,正反应速率与逆反应速率相等,达到化学平衡状态,此后升高温度,逆反应速率增大程度较大,故平衡向逆反应方向移动,则逆反应为吸热反应,正反应为放热反应,因此可以判断反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH<0,⑨不正确,画×;
2AB3(g)的ΔH<0,⑨不正确,画×;
⑩2A(g)+2B(g)![]() 3C(g)+D(s),该反应物在建立平衡的过程中,气体分子数在减少,若增大压强,则化学平衡向正反应方向移动,反应物的百分含量将减小,因此,图b不能表示压强(P)对反应2A(g)+2B(g)
3C(g)+D(s),该反应物在建立平衡的过程中,气体分子数在减少,若增大压强,则化学平衡向正反应方向移动,反应物的百分含量将减小,因此,图b不能表示压强(P)对反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,⑩不正确,画×;
3C(g)+D(s)的影响,⑩不正确,画×;
醋酸是弱电解质,与氨气反应后可以生成强电解质醋酸铵,故溶液的导电性增强,因此,图c不能表示向醋酸溶液通入氨气时溶液导电性随氨气量的变化,不正确,画×;
根据图d信息可知,pH约为3时,溶液中Fe3+的浓度为0,而Cu2+的浓度较大,因此,除去CuSO4溶液中的Fe3+,可加入NaOH调节pH至3~4,正确,画√;
(4)由图象中的信息可知,i与iv、v比较,前者单位时间内氧气浓度的变化量较小,氧气消耗得越快,说明吸氧腐蚀速率越快,因此,可以说明盐溶液可以加快吸氧腐蚀速率,正确,画√;
ii与iii、iv与v比较,仅阴离子种类不同,但是其腐蚀速率明显不同,说明吸氧腐蚀速率与阴离子种类有关,不正确,画×;
由图象可知,在相同条件下,硫酸铵溶液的腐蚀速率明显快于硫酸钠溶液,因此,向实验v溶液中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快,正确,画√;
向实验ii溶液中加等体积的0.5mol·L-1(NH4)2SO4,两种溶质的物质的量浓度均变为原来的一半,虽然铵根离子浓度与原溶液相同,但是氯离子的浓度变小了,故吸氧腐蚀速率减小,不正确,画×。


科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的结构简式 看,苯分子中含有碳碳双键,应属于烯烃
看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
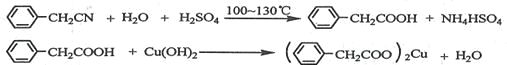
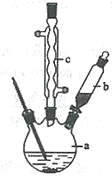
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是_____________________;仪器c的名称是______________,其作用是___________________________________________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是________________(填标号)。
A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是_____________,最终得到44 g纯品,则苯乙酸的产率是________。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A | B | C | D | |
反应装置或图象 |
|
|
|
|
实验现象或图象信息 | 温度计的水银柱上升 | 反应物总能量大于生成物总能量 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲处液面低于乙处液面 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80 ℃时,在2 L密闭容器中充入0.40 mol N2O4,发生反应N2O4(g) ![]() 2NO2(g) ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
2NO2(g) ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
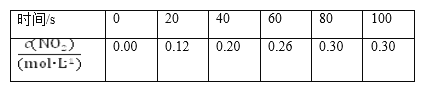
下列判断正确的是( )。
A.升高温度该反应的平衡常数K减小
B.20~40 s内,v(N2O4)=0.004 mol·L-1·s-1
C.反应达平衡时,吸收的热量为0.30Q kJ
D.100 s时再通入0.40 mol N2O4,达到新平衡时N2O4的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和 ![]() 如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×1017 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的
A.KIB.![]() C.KBrD.
C.KBrD.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的说法错误的是( )
A.pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③
B.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为①>②>③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能抑制CH3COO-水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ/mol。实验测得有关数据如下表:
2NH3(g) △H=-92.4 kJ/mol。实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是 ( )。
A.达平衡时氨气的体积分数:①>③
B.三个容器内反应的平衡常数:③>①>②
C.放出热量关系:a < b <92.4
D.H2的转化率:①> ②> ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com