
【题目】二氧化碳气体可以用石灰石与稀盐酸反应制取,某同学在做该实验时,发现实验室中暂时没有稀盐酸,经过思考,他选择了稀硝酸。仅选择稀硝酸这一环节,该同学运用的方法是
A.实验法
B.比较法
C.观察法
D.分类法
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
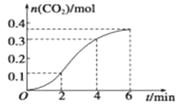
A. 反应在2~4 min内平均反应速率最大
B. 反应开始4 min内温度比浓度对反应速率的影响大
C. 4 min后,反应速率减小的主要原因是c(H+)减小
D. 反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的气态物质。
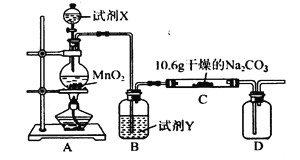
(1)装置A中发生反应的离子方程式为_______________________________________。
(2)装置B中试剂Y应为_________________。
(3)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物),装置C中只有氯化钠和碳酸氢钠。若C中有0.1 mol Cl2参加反应,可推知C中反应生成的含氯氧化物为______________(写化学式)。
(4)该实验装置中明显存在不足之处,改进的措施为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )

A. 装置③可用于收集H2、CO2、Cl2、NH3等气体
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置①常用于分离互不相溶的液体混合物
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数量的各物质所含原子个数按由大到小顺序排列的是( )
①0.5 mol 氨气 ②4 g 氦气 ③4 ℃时9 mL水 ④0.2 mol H3PO4
A. ①④③② B. ④③②① C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为________________。组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为____________________。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是____________、___________, 1个氯磺酰氰酯分子中含有σ键的数目为______________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为_________________。
(3)ClO4-的空间构型为__________________。
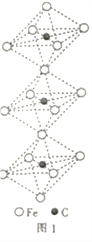
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为________________。
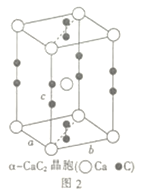
(5)电石(CaC2)是制备氯化氰(ClCN)的重要原料。四方相碳化钙(CaC2)的晶胞结构如上图2所示,其晶胞参数分别为a、b、c,且a=b,c=640pm。已知四方相碳化钙的密度为1.85g·cm-3,[C≡C]2-中键长为120pm,则成键的碳原子与钙原子的距离为________pm和_______pm。(设阿伏加德罗常数的数值为6×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法不正确的是

A. 该装置将化学能转化为电能
B. 为了增加灯泡亮度,可以将电极碳棒变得粗糙多孔
C. 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a
D. 该电池的总反应:2H2+O2=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中对于相关物质的分类全部正确的一组是( )
编号 | 碱性氧化物 | 酸性氧化物 | 非电解质 | 强电解质 |
A | Na2O | CO2 | NH3 | 醋酸铵 |
B | Na2O2 | SO2 | 乙醇 | NaHCO3 |
C | Al2O3 | SO3 | CO2 | Fe(OH)3 |
D | Fe3O4 | CO | Cl2 | NH4Cl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
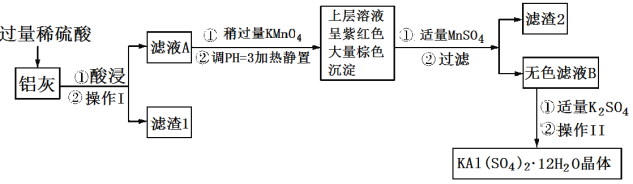
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4—转化为Mn2+):________________。
(5)已知:在pH=3、加热条件下,MnO![]() 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com