
”¾ĢāÄæ”æŅŃÖŖ£ŗŹµŃéŹŅæɹ©Ń”ŌńµÄÓĆÓŚČ„³żĘųĢåŌÓÖŹµÄŹŌ¼ĮÓŠ£ŗÅØĮņĖį”¢ĪŽĖ®ĀČ»ÆøĘ”¢ĪåŃõ»Æ¶žĮ×”¢¼īŹÆ»Ņ£ØÖ÷ŅŖ³É·ÖĪŖNaOHŗĶCaO£© 
¢ŁŹµŃéŹŅÓĆČēĶ¼1ĖłŹ¾×°ÖĆ½ųŠŠ“æ¾»øÉŌļµÄĒāĘų»¹ŌŃõ»ÆĢśŹµŃ飮a×°ÖĆĆū³ĘĪŖ £¬ ·½æņBČӦєÓĆČēĶ¼2×°ÖĆ£ØĢī”°¢ń”±»ņ”°¢ņ”±£©£¬Ń”ÓĆµÄ³żŌÓŹŌ¼ĮĪŖ£ØĢīŹŌ¼ĮĆū³Ę£©£®
¢ŚŹµŃéŹŅ³£ÓĆ36.5%ÅØŃĪĖį£Ø¦Ń=1.2gcm©3£©ÅäÖĘĻ”ŃĪĖį£¬ČōŅŖÅäÖĘ500mL£¬0.5molL©1Ļ”ŃĪĖį£¬ŠčÓĆĮæĶ²Č”ÓĆÅØŃĪĖįmL£®
¢ŪŠ“³ö×°ÖĆCÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½²¢ÓƵ„ĻßĒűźĆ÷µē×ÓµÄ×ŖŅĘ £® ŹµŃé½įŹųŹ±Ó¦øĆ²ÉČ”µÄ²Ł×÷ŹĒ £®
”¾“š°ø”泤¾±Ā©¶·£»¢ń£»¼īŹÆ»Ņ£»8.3£»![]() £»ĻČĶ£Ö¹¼ÓČČ£¬ĄäČ“µ½ŹŅĪĀ£¬ŌŁĶ£Ö¹ĶØH2
£»ĻČĶ£Ö¹¼ÓČČ£¬ĄäČ“µ½ŹŅĪĀ£¬ŌŁĶ£Ö¹ĶØH2
”¾½āĪö”æ½ā£ŗ¢Ł¾ŻĶ¼æÉÖŖŅĒĘ÷aŹĒ³¤¾±Ā©¶·£¬H2ÓėŃõ»ÆĢś·“Ó¦Ö®Ē°Ņ»¶ØŅŖøÉŌļ£¬·ńŌņ“ļ²»µ½ĖłŠčĪĀ¶Č£¬A×°ÖĆÖʵĆH2ÖŠÓŠHClŗĶH2OŌÓÖŹ£¬Ó¦Ń”ŌńŹ¢ÓŠ¼īŹÆ»ŅµÄUŠĪ¹Ü£¬¹Ź“š°øĪŖ£ŗI£¬¼īŹÆ»Ņ£»¢ŚÅØŃĪĖįµÄĪļÖŹµÄĮæÅضČĪŖc= ![]() =
= ![]() mol/L=12mol/L£¬ÉčĖłŠčÅØĮņĖįµÄĢå»żĪŖV£¬ŌņÓŠV”Į12mol/L=O.5L”Į0.2mol/L£¬
mol/L=12mol/L£¬ÉčĖłŠčÅØĮņĖįµÄĢå»żĪŖV£¬ŌņÓŠV”Į12mol/L=O.5L”Į0.2mol/L£¬
ŌņV= ![]() =O.0083L=8.3mL£¬
=O.0083L=8.3mL£¬
¹Ź“š°øĪŖ£ŗ8.3£»¢ŪøĆ·“Ó¦ÖŠZnŌŖĖŲ»ÆŗĻ¼ŪÓÉ0¼Ū±äĪŖ+2¼Ū”¢HŌŖĖŲ»ÆŗĻ¼ŪÓÉ+1¼Ū±äĪŖ0¼Ū£¬Ęä×ŖŅʵē×ÓŹżĪŖ2£¬ĖłŅŌĘä×ŖŅʵē×Ó·½ĻņŗĶŹżÄæĪŖ ![]() £¬
£¬
H2»¹ŌŃõ»ÆĢśµÄŹµŃé½įŹųŹ±£¬ĻČĶ£Ö¹¼ÓČČ£¬ĄäČ“µ½ŹŅĪĀ£¬ŌŁĶ£Ö¹ĶØH2 £¬ ·ĄÖ¹Éś³ÉµÄĢś±»Ńõ»Æ£®
¹Ź“š°øĪŖ£ŗ ![]() £»ĻČĶ£Ö¹¼ÓČČ£¬ĄäČ“µ½ŹŅĪĀ£¬ŌŁĶ£Ö¹ĶØH2 £®
£»ĻČĶ£Ö¹¼ÓČČ£¬ĄäČ“µ½ŹŅĪĀ£¬ŌŁĶ£Ö¹ĶØH2 £®
¢Łøł¾ŻŹµŃéŹŅ³£ÓĆŅĒĘ÷½ā“š£»A×°ÖĆÖʵĆH2ÖŠÓŠHClŗĶH2OŌÓÖŹ£¬Ó¦Ń”ŌńŹ¢ÓŠ¼īŹÆ»ŅµÄUŠĪ¹Ü½ųŠŠ³żŌÓŗĶøÉŌļ£»¢ŚĻČ¼ĘĖć³öÅØŃĪĖįµÄĪļÖŹµÄĮæÅضČc= ![]() £¬Č»ŗóøł¾ŻČÜŅŗĻ”ŹĶĒ°ŗóĪļÖŹµÄĮæ²»±ä¼ĘĖćĖłŠčÅØŃĪĖįµÄĢå»ż£»¢ŪøĆ·“Ó¦ÖŠZnŌŖĖŲ»ÆŗĻ¼ŪÓÉ0¼Ū±äĪŖ+2¼Ū”¢HŌŖĖŲ»ÆŗĻ¼ŪÓÉ+1¼Ū±äĪŖ0¼Ū£¬Ęä×ŖŅʵē×ÓŹżĪŖ2£¬øł¾ŻĻČ³·µ¼¹ÜŗóĻØĆš¾Ę¾«µĘ£¬·ĄÖ¹Ė®µ¹Īüæ¼ĀĒ£®
£¬Č»ŗóøł¾ŻČÜŅŗĻ”ŹĶĒ°ŗóĪļÖŹµÄĮæ²»±ä¼ĘĖćĖłŠčÅØŃĪĖįµÄĢå»ż£»¢ŪøĆ·“Ó¦ÖŠZnŌŖĖŲ»ÆŗĻ¼ŪÓÉ0¼Ū±äĪŖ+2¼Ū”¢HŌŖĖŲ»ÆŗĻ¼ŪÓÉ+1¼Ū±äĪŖ0¼Ū£¬Ęä×ŖŅʵē×ÓŹżĪŖ2£¬øł¾ŻĻČ³·µ¼¹ÜŗóĻØĆš¾Ę¾«µĘ£¬·ĄÖ¹Ė®µ¹Īüæ¼ĀĒ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆĖ®ČČŗĶÓŠ»śČܼĮµČČķ»Æѧ·½·Ø£¬æÉŗĻ³É³öŗ¬ÓŠÓŠ»śŌÓ»ÆŠæ”¢ÕąŅŌ¼°ÉéµČ½šŹōµÄĪų»ÆĪļ£¬ĒŅøĆĪų»ÆĪļ¾ßÓŠĄė×Ó½»»»”¢“߻Ɣ¢Īüø½”¢°ėµ¼ĢåµČŠŌÄÜ£¬ĻŌŹ¾³öĮ¼ŗƵÄÓ¦ÓĆĒ°¾°”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Šæ»łĢ¬Ō×ÓŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ________________”£ŌŖĖŲÕąÓėÉéÖŠ£¬µŚŅ»µēĄėÄܽĻ“óµÄŹĒ_________£ØĢīŌŖĖŲ·ūŗÅ£¬ĻĀĶ¬£©£¬»łĢ¬Ō×ÓŗĖĶāĪ“³É¶Ōµē×ÓŹż½ĻÉŁµÄŹĒ_______________”£
£Ø2£©H2SeO3·Ö×ÓÖŠSeŌ×ÓµÄŌӻƊĪŹ½ĪŖ____________£¬H2SeO4µÄĖįŠŌ±ČH2SeO3Ē棬ŌŅņŹĒ_________”£
£Ø3£©ĘųĢ¬SeO3·Ö×ÓµÄĮ¢Ģå¹¹ŠĶĪŖ____________£¬ÓėSeO3»„ĪŖµČµē×ÓĢåµÄŅ»ÖÖĄė×ÓĪŖ_______£ØĢīĄė×Ó·ūŗÅ£©”£
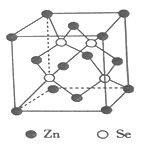
£Ø4£©Īų»ÆŠæŹĒŅ»ÖÖÖŲŅŖµÄ°ėµ¼Ģå²ÄĮĻ£¬Ę侧°ū½į¹¹ČēĶ¼ĖłŹ¾£¬øĆ¾§°ūÖŠĪųŌ×ÓµÄÅäĪ»ŹżĪŖ____________£¬ČōøĆ¾§°ūĆܶČĪŖ¦Ńg”¤cm-3£¬Īų»ÆŠæµÄĦ¶ūÖŹĮæĪŖMg”¤mol-1”£ÓĆNA“ś±ķ°¢·üŁ¤µĀĀŽ³£ŹżµÄŹżÖµ£¬Ōņ¾§°ū²ĪŹżØ»ĪŖ____________nm”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ×ö·ØµÄÄæµÄÓėøıä»Æѧ·“Ó¦ĖŁĀŹĪŽ¹ŲµÄŹĒ
A.Å£ÄĢŌŚ±łĻäĄļ±£“ę
B.Ļņ²£Į§ÖŠ¼ÓČėŃõ»ÆĒ¦
C.øßĀÆĮ¶ĢśĒ°ĻČ½«ĢśæóŹÆ·ŪĖé
D.ŌŚøāµć°ü×°ÄŚ·ÅÖĆŠ”°ü³żŃõ¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖÜĮĻÖ»ÄÜŅ»“ĪŠŌŹ¹ÓĆ£¬²»ÄÜČČŠŽ²¹µÄŹĒ
A.¾ŪĀČŅŅĻ©B.·ÓČ©Ź÷Ö¬
C.¾Ū¼×»ł±ūĻ©Ėį¼×õ„D.¾Ū±½ŅŅĻ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢśŹĒµŲĒņÉĻ·Ö²¼×ī¹ć”¢×ī³£ÓĆµÄ½šŹōÖ®Ņ»”£Ēė»Ų“šĻĀĮŠ¹ŲÓŚFeŌŖĖŲµÄĪŹĢā£ŗ
£Ø1£© FeCl3ČÜŅŗĻŌĖįŠŌ£¬ĘäŌŅņŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©________________________”£
²»¶Ļ¼ÓČČFeCl3ČÜŅŗŹ±£¬ÕōøÉĘäĖ®·Ö²¢×ĘÉÕµĆµ½µÄ¹ĢĢåŹĒ______________________”£
£Ø2£©ŌŚÅäÖĘFeCl3ČÜŅŗŹ±£¬ĪŖ·ĄÖ¹»ė×Ē£¬Ó¦¼ÓČė_______________”£
£Ø3£©ĻņFeCl3ČÜŅŗÖŠ¼ÓČėÉŁĮæNaHCO3ÅØČÜŅŗ£¬Ō¤¼ĘæÉÄÜ擵½µÄĻÖĻóŹĒ________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņ150mLŅ»¶ØÅØ¶ČµÄHNO3ÖŠ¼ÓČė44.8Ķʬ£¬Ņ»¶ĪŹ±¼äŗó£¬ĶʬĶźČ«Čܽā£¬ĻõĖįĒ”ŗĆĶźČ«·“Ó¦£¬¹²ŹÕ¼Æµ½ĘųĢå(NO”¢NO2)22.4L£ØŅŃÕŪĖć³É±ź×¼×“æö£©£¬ŌņøĆHNO3µÄĪļÖŹµÄĮæÅØ¶ČŹĒ£Ø””””£©
A. 10.0molL-1 B. 16.0molL-1 C. 12.4molL-1 D. 18.7molL-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬½«Ä³Ņ»ŌŖĖįHAŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬Į½ÖÖČÜŅŗµÄÅضČŗĶ»ģŗĻŗóĖłµĆČÜŅŗµÄpHČēĻĀ±ķ£¬Ēė»Ų“š£ŗ
ŹµŃ鱹ŗÅ | HAĪļÖŹµÄĮæÅØ¶Č (mol”¤L-1) | NaOHĪļÖŹµÄĮæÅضČ(mol”¤L-1) | »ģŗĻČÜŅŗµÄpH |
¼× | 0.2 | 0.2 | pH£½a |
ŅŅ | c | 0.2 | pH£½7 |
±ū | 0.2 | 0.1 | pH£¾7 |
¶” | 0.1 | 0.1 | pH£½9 |
£Ø1£©²»æ¼ĀĒĘäĖü×éµÄŹµŃé½į¹ū£¬µ„“Ó¼××éĒéæö·ÖĪö£¬ČēŗĪÓĆa (»ģŗĻČÜŅŗµÄpH)Ą“ĖµĆ÷HAŹĒĒæĖį»¹ŹĒČõĖį_________________________________________________”£
£Ø2£©²»æ¼ĀĒĘäĖü×éµÄŹµŃé½į¹ū£¬µ„“ÓŅŅ×éĒéæö·ÖĪö£¬CŹĒ·ńŅ»¶ØµČÓŚ0.2______(Ń”Ģī”°ŹĒ”±»ņ”°·ń”±)”£»ģŗĻŅŗÖŠĄė×ÓÅضČc(A£)Óė c(Na+)µÄ“󊔹ŲĻµŹĒ____________________”£
£Ø3£©±ū×鏵Ńé½į¹ū·ÖĪö£¬HAŹĒ________Ėį£ØŃ”Ģī”°Ēæ”±»ņ”°Čõ”±£©”£øĆ»ģŗĻČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ________________________________”£
£Ø4£©¶”×鏵ŃéĖłµĆ»ģŗĻČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(OH£)£½_____________mol”¤L-1”£Š“³öøĆ»ģŗĻČÜŅŗÖŠµÄĻĀĮŠĖćŹ½µÄ¾«Č·½į¹ū (Źż¾Ż²»ÄÜ×ö½üĖĘ¼ĘĖć£¬²»ÓĆ»Æ¼ņ)”£c(Na+)£c(A-)£½____________mol”¤L-1 c(OH-)£c(HA)£½____________mol”¤L-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗÖŠ“óĮæ“ęŌŚŅŌĻĀĪåÖÖĄė×Ó£ŗCl©”¢SO42©”¢Fe3+”¢H+”¢M£¬ĘäĪļÖŹµÄĮæÅضČÖ®±ČĪŖc£ØCl©£©£ŗc£ØSO42©£©£ŗc£ØFe3+£©£ŗc£ØH+£©£ŗc£ØM£©=5£ŗ3£ŗ2£ŗ3£ŗ2£¬ŌņMæÉÄÜŹĒ£Ø £©
A.Ag+
B.Mg2+
C.NO ![]()
D.Na+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŌŖĖŲ“¦ÓŚÖÜĘŚ±ķµŚČżÖÜĘŚµÄŹĒ
A. ¹č B. Ēā C. Ģ¼ D. µŖ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com