
| A. | P4和CH4分子的立体构型都是正四面体形且键角都为109°28' | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有6个 | |
| C. | 单质的晶体中一定不存在阴离子 | |
| D. | SO2、BF3、NC13分子中所有原子的最外层电子均未达到8电子稳定结构 |
分析 A.白磷和甲烷虽然都是正四面体结构,但是甲烷中四个H原子位于四个顶点,C原子位于四面体的中心;
B.NaCl晶体中 与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置;
C.由阴离子和阳离子构成的物质属于离子化合物;
D.分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断.
解答 解:A.白磷和甲烷虽然都是正四面体结构,但是甲烷中四个H原子位于四个顶点,C原子位于四面体的中心,C-H键键角为白磷键角为109°28ˊ;白磷分子中四个P原子位于四个顶点上键角为60°,故A错误;
B.NaCl晶胞结构为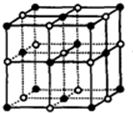 ,根据NaCl晶体的晶胞示意图可以看出,与每个Na+距离最近且相等的Cl-共有6个,与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置,共有12个,故B错误;
,根据NaCl晶体的晶胞示意图可以看出,与每个Na+距离最近且相等的Cl-共有6个,与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置,共有12个,故B错误;
C.由阴离子和阳离子构成的物质属于离子化合物,则含有阴离子的一定是离子化合物,所以在单质的晶体中一定不存在阴离子,故C正确;
D.NC13中N原子最外层电子数5+化合价的绝对值3=8,所以N原子达到8电子稳定结构;NC13中C1原子最外层电子数7+化合价的绝对值1=8,所以C1原子达到8电子稳定结构,SO2 分子中S原子最外层电子数为6+4=10,不满足8电子结构,BF3中,B元素位于第ⅢA族,则3+3≠8,不满足分子中所有原子都满足最外层8电子结构,故D错误;
故选C.
点评 本题考查晶体结构、原子结构等知识,掌握8电子结构判断的方法,注意利用化合价(共价键数目)与最外层电子数来分析,注意氯化钠的结构高频考点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.
和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有三个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
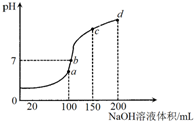 室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )
室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )| A. | a点水的电离程度最大 | B. | b点c(NH4+)=2c(SO42-) | ||
| C. | c点c(NH4+)+c(NH3•H2O)=c(Na+) | D. | d点c(NH4+)+c(Na+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
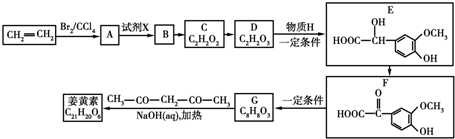


 .
.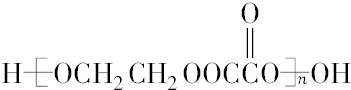 .
.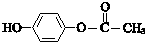 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com