
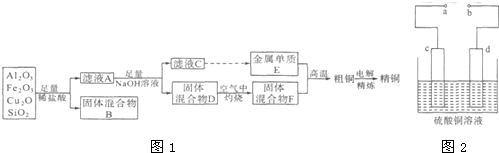
分析 某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02,加入足量稀盐酸过滤固体混合物为Si02,Cu2O溶于酸反应生成铜和铜盐,滤液A中为亚铁离子,铝离子和铜离子,加入足量氢氧化钠溶液过滤得到固体混合物为氢氧化铜、氢氧化铁,滤液为C为AlO2-离子,通入二氧化碳生成氢氧化铝沉淀,氢氧化铝分解得到氧化铝,电解熔融氧化铝得到金属E为Al,固体混合物D空气中加热灼烧得到氧化铁和氧化铜,和铝发生铝热反应得到粗铜,含有铁杂质,粗铜精炼得到精铜;
(1)上述分析可知滤液A中,Cu2O溶于酸反应生成铜和铜盐,铜和铁离子反应生成亚铁离子,所以滤液A中为亚铁离子,检验滤液A中存在的亚铁离子可以用KSCN和氯水检验;
(2)铝热反应是铝和氧化铁反应生成铁;
(3)等pH的NaAl02和NaOH两份溶液中,NaAl02和促进水的电离显碱性,NaOH溶液抑制水的电离,由水电离出的c(OH一)前者为后者的108倍,结合溶液中离子积常数计算;
(4)Cu2+和CO32-生成CuCO3沉淀②Cu2+和CO32-和水反应生成Cu(OH)2沉淀和二氧化碳;
(5)①在粗铜的电解精炼过程中,c为粗铜板作阳极应连接电源的正极,c电极(即阳极)上铜和比铜活泼的铁发生反应的,方程式有 Fe-2e-=Fe2+;Cu-2e-=Cu2+;
②酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化),故滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液.亚铁离子用酸性高锰酸钾溶液滴定法测定,离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;空气中的氧气可将亚铁离子氧化,导致消耗高锰酸钾的量减少,测得铁元素的含量会偏低.
解答 解:(1)分析可知滤液A中,Cu2O溶于酸反应生成铜和铜盐,铜和铁离子反应生成亚铁离子,所以滤液A中为亚铁离子,生成该离子的离子方程式为,Cu+2Fe3+=Cu2++2Fe2+,检验滤液A中存在的亚铁离子可以用KSCN和氯水检验;
故答案为:Fe2+,Cu+2Fe3+=Cu2++2Fe2+,硫氰化钾溶液和新制氯水;
(2)铝热反应是铝和氧化铁反应生成铁,金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)常温下.等pH的NaAl02和NaOH两份溶液中,设PH为x,NaAl02溶液中水电离出C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-x}}$,NaOH溶液中水电离出氢氧根离子浓度C(OH-)=10-xmol/L,由水电离出的c(OH一)前者为后者的108倍,$\frac{1{0}^{-14}}{1{0}^{-x}}$=10-xm×108,x=11,则两种溶液的pH=11,
故答案为:1l;
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀,Cu2+和CO32-生成CuCO3沉淀,离子方程式为:Cu2++CO32-=CuCO3↓,Cu2+和CO32-和水反应生成Cu(OH)2沉淀和二氧化碳,离子方程式为:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑,
故答案为:Cu2++CO32-=CuCO3↓;Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑;
(5)①在粗铜的电解精炼过程中,c为粗铜板作阳极,则a端应连接电源的正极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极(即阳极)上铜和比铜活泼的铁发生反应的,方程式有 Fe-2e-=Fe2+;Cu-2e-=Cu2+,
故答案为:正;Fe-2e-=Fe2+、Cu-2e-=Cu2+;
②可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量.滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是 酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化).电解时铁变成了亚铁离子,用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素,离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;滴定时,锥形瓶中的溶液会接触空气,氧气可将亚铁离子氧化,导致消耗高锰酸钾的量减少,测得铁元素的含量会偏低.
故答案为:酸性高锰酸钾溶液有强氧化性,能腐蚀碱式滴定管上的橡胶管(或易使橡胶管老化),所以不能用碱式滴定管盛高锰酸钾溶液,5Fe2++MnO42-+8H+=5Fe2++Mn2++4H2O,偏低.
点评 本题考查了铜的单质及其化合物的性质及转化、电化学、氧化还原滴定等,涉及范围较广,综合性较强,题目难度中等.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
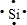 ;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.
;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑. .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
某反应由两步反应A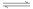 B
B C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应中ΔH=E1-E4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2-
C.FeCl3溶液:K+、Na+、Fe2+、S2-
D.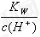 =0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
21世纪是钛的世纪。在800~1 000 ℃时电解熔融TiO2可制得钛,装置如图所示。下列叙述正
确的是( )

A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e-===Ti+2O2-
D.每生成0.1 mol钛,转移电子0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ①②③④⑦ | C. | ③⑤⑥ | D. | ①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①③④⑤⑥ | C. | ①③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,0.2mol•L-1醋酸溶液与0.1mol•L-1醋酸中的c(H+ )之比 | |
| B. | 在Na2O2晶体中阳离子与阴离子的物质的量之比 | |
| C. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积之比 | |
| D. | 22.4LCO2与22.4L CO所含氧原子数目之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com