
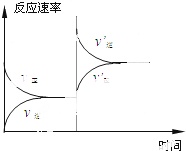
| A. | 加压 | B. | 增加O2的浓度 | ||
| C. | 使用催化剂 | D. | 同时增大SO3和O2的浓度 |
分析 该反应是一个反应前后气体体积增大、吸热的可逆反应,第一次达到平衡后,改变条件,正逆反应速率都增大,且逆反应速率大于正反应速率,说明平衡向逆反应方向移动,且改变条件时与原平衡点没有接触点.
解答 解:A.该反应是一个反应前后气体体积增大、吸热的可逆反应,增大压强,平衡向逆反应方向移动,且正逆反应速率都增大,再次达到平衡状态时,正逆反应速率都大于原来平衡反应速率,故A正确;
B.增加氧气浓度瞬间,能增大逆反应速率,但反应物浓度不变,所以正反应速率不变,应该与原来平衡点有接触点,所以不符合图象,故B错误;
C.催化剂能同等程度的改变正逆反应速率,只改变反应速率但不影响平衡移动,所以改变条件时正逆反应速率仍然相等,不符合图象,故C错误;
D.同时增大SO3和O2的浓度,正逆反应速率都增大,如果加入氧气浓度远远大于三氧化硫浓度,则平衡逆向移动,故D正确;
故选AD.
点评 本题以图象分析为载体考查外界条件对化学反应速率及化学平衡移动的影响,熟悉外界条件对反应速率及平衡移动影响原理是解本题关键,注意分析改变条件时与原平衡点是否接触,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:2 | C. | 3:4 | D. | 5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
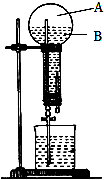 如图是做过氨气溶于水的喷泉实验装置,实验完成后烧瓶里的空间被分为两个部分:A和B,请根据实验内容按要求填空:
如图是做过氨气溶于水的喷泉实验装置,实验完成后烧瓶里的空间被分为两个部分:A和B,请根据实验内容按要求填空: NH4++OH-(用离子方程式表示);
NH4++OH-(用离子方程式表示);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),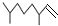 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )| A. | 2,4-二甲基-1-庚烯的分子式为C9H18 | |
| B. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| D. | 1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则其燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,则石墨的燃烧热为110,5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,故该反应一定能自发进行 | |
| D. | 热化学方程式中的化学计量数表示物质的量,可以是分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的水和冰相比较,冰的能量高 | |
| B. | 化学反应过程中能量的变化只有吸热和放热两种表现形式 | |
| C. | 化学反应既遵循质量守恒,也遵循能量守恒 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com