
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。

(1)将0.050molSO2和0.030molO2放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
①从平衡角度分析采用过量O2的目的是___。
②该条件下反应的平衡常数K=___。
③已知:K(300℃)>K(350℃),正反应是___(填“吸”或“放”)热反应。若反应温度升高,SO2的转化率___(填“增大”“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图I所示。平衡状态由A变到B时,平衡常数K(A)___K(B)(填“大于”“等于”或“小于”,下同)。
(3)如图II所示,保持温度不变,将2molSO2和1molO2加入甲容器中,将4molSO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲___乙。
②若保持乙中压强不变,向甲、乙容器中通人等质量的氦气,达到新平衡时,SO3的体积分数甲___乙。
【答案】提高二氧化硫的转化率 1600 放 减小 = < >
【解析】
(1)①采用过量的O2,可以提高二氧化硫转化率;
②将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则:
2SO2(g)+ O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
再根据K= 计算平衡常数;
计算平衡常数;
③已知:K(300℃)>K(350℃),升高温度平衡常数减小,说明平衡逆向移动,而升高温度平衡向吸热反应方向移动;
(2)平衡常数只受温度影响,温度不变,平衡常数不变;
(3)①甲为恒温恒容容器,若移动活塞P,使乙的容积和甲相等,为恒温恒容容器,乙中加入4mol三氧化硫相当于加入2mol三氧化硫,再加入2mol三氧化硫,增大压强,平衡正向进行,SO3的体积分数增大;
②甲为恒温恒容容器,加入氦气总压增大,分压不变,平衡不变,乙中加入氦气为保持恒压,体积增大,压强减小,平衡逆向进行,达到新平衡时,SO3的体积分数减小。
(1)①从平衡角度分析采用过量O2的目的是,利用廉价原料提高物质转化率,加入氧气提高二氧化硫的转化率;
②将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则:
2SO2(g)+ O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
平衡常数K= =
=![]() =1600;
=1600;
③K(300℃)>K(350℃),说明温度越高平衡常数越小,反应逆向进行,升温平衡向吸热反应方向进行,正反应为放热反应,升温平衡逆向进行,二氧化硫转化率减小;
(2)平衡常数只受温度影响,与压强无关,平衡状态由A变到B时,二者温度相同,故平衡常数K(A)=K(B);
(3)将2mol SO2和1mol O2加入甲容器中,将4mol SO3加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍,可知甲、乙中最后达到相同的平衡状态;
①若移动活塞P,使乙的容积和甲相等,增大压强,平衡正向进行,SO3的体积分数增大,SO3的体积分数甲<乙;
②甲为恒温恒容容器,加入氦气总压增大,分压不变,平衡不变,乙中加入氦气,为保持恒压,体积增大,压强减小,平衡逆向进行,达到新平衡时,SO3的体积分数减小,SO3的体积分数甲大于乙。


科目:高中化学 来源: 题型:
【题目】如图是实验室制备纯净氯气的实验装置,试回答下列问题:

(1)写出下列仪器的名称:A __________________ ,B ________________ 。
(2)写出制备氯气的反应的离子方程式: __________________ 。
(3)装置C的作用是 __________________ ,装置D的作用是 __________________ 。
(4)装置F的作用是 __________________ (用化学方程式表示)。
(5)实验结束时,需要先撤去B与C之间的导管,然后再撤掉酒精灯。若先撤掉酒精灯,而不撤去B与C之间的导管,则会导致 __________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质都是人体基本营养物质。请回答下列问题:
(1)在试管中加入![]() 淀粉和
淀粉和![]() 20%的
20%的![]() 溶液,加热3~4min,然后用碱液中和试管中的
溶液,加热3~4min,然后用碱液中和试管中的![]() 溶液。
溶液。
①淀粉完全水解生成的有机物的分子为___________________________。
②若要检验淀粉已经发生了水解,可取少量上述溶液并向其中加入___________________________(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液,向其中加入几滴碘水,可观察到___________________________。
(2)油脂在人体内通过水解生成___________________________和丙三醇,再氧化分解,为人体提供能量。
(3)为了鉴别某白色纺织品的成分是蚕丝还是“人造丝”,通常选用的方法是_____________(填序号)。
A.滴加稀盐酸 B.滴加浓硫酸 C.滴加酒精 D.在火焰上灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
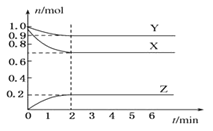
(1)该反应的化学方程式为___。
(2)反应开始至2min,气体Z的平均反应速率为___。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的___倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ___(填”增大”“减小”或”相等”)。
③若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___反应(填“放热”或“吸热”)。
(4)在一密闭容器中发生反应N2(g)+3H2(g) ![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
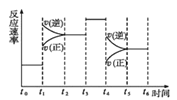
①处于平衡状态的时间段是___(填字母代号)。
A.t0t1 B.t1t2 C.t2t3 D.t3t4 E.t4t5 F.t5t6
②判断t1、t3、t4时刻分别改变的一个条件是:t1时刻___;t3时刻___;t4时刻___。 (填字母代号)
A. 增大压强 B.减小压强 C.升高温度 D. 降低温度 E.加催化剂 F.恒温恒容时充入氮气
③依据上述②中的结论,下列时间段中,氨的百分含量最高的是___(填字母代号)。
A.t0t1 B.t2t3 C.t3t4 D.t5t6。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA
B.完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA
C.100g 98%的浓硫酸中含氧原子个数为4NA
D.1L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
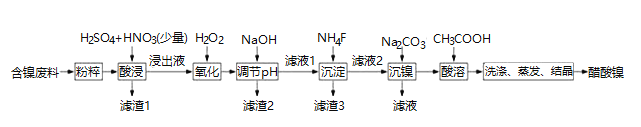
【题目】醋酸镍 ![]() 是一种重要的化工原料,一种以含镍废料
是一种重要的化工原料,一种以含镍废料![]() 含NiS、
含NiS、![]() 、FeO、CaO、
、FeO、CaO、![]() 为原料制取醋酸镍的工艺流程图如下图所示:
为原料制取醋酸镍的工艺流程图如下图所示:
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH | 物质 |
|
|
|
|
| 微溶 |
|
|
|
| 可溶 |
|
|
|
| 难溶 |
|
|
|
|
|
![]() 的电子式为_________________。
的电子式为_________________。
![]() 调节pH步骤中,溶液pH的调节范围是_________________。
调节pH步骤中,溶液pH的调节范围是_________________。
![]() 滤渣1和滤渣3主要成分的化学式分别是_________________、_________________。
滤渣1和滤渣3主要成分的化学式分别是_________________、_________________。
![]() 酸浸过程中,lmolNiS失去
酸浸过程中,lmolNiS失去![]() 个电子,同时生成两种无色有毒气体,写出该反应的化学方程式:________。
个电子,同时生成两种无色有毒气体,写出该反应的化学方程式:________。
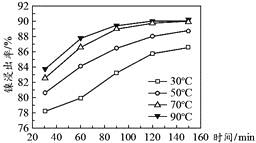
![]() 保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如下图所示,酸浸的最佳温度与时间分别为_________________。
保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如下图所示,酸浸的最佳温度与时间分别为_________________。
![]() 沉镍过程中,若
沉镍过程中,若![]() ,欲使100mL该滤液中的
,欲使100mL该滤液中的![]() 沉淀完全
沉淀完全![]() ,则需要加入
,则需要加入![]() 固体的质量最少为___________
固体的质量最少为___________![]() 保留小数点后2位有效数字
保留小数点后2位有效数字![]() 。
。
![]() 近年来镍氢电池发展很快,它可由
近年来镍氢电池发展很快,它可由![]() 跟
跟![]() 中各元素化合价均可看作是零
中各元素化合价均可看作是零![]() 组成:
组成:![]()
![]()
![]() 。该电池放电时,负极反应是________。
。该电池放电时,负极反应是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草木灰主要成分是碳酸钾。现从草木灰中提取钾盐,并用实验检验其中的S![]() 、C
、C![]() 和Cl-。
和Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解和沉淀,③______,④_______,⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示___。
A.左盘重,样品轻 B.左盘轻,砝码重
C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行②③④操作时都要用到玻璃棒,其作用分别是_____、______、______。
(4)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在三支试管里。
①在第一支试管里加入稀盐酸,可观察有___生成,证明溶液中有_____;
②在第二支试管里加入足量稀盐酸后,再加入氯化钡溶液,可观察有________生成,证明溶液中有__________;
③在第三支试管里加入足量稀硝酸后,再加入硝酸银溶液,可观察有______生成,证明溶液中有Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:

下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑在工业上应用价值广泛,它的一种提取工艺流程如下:
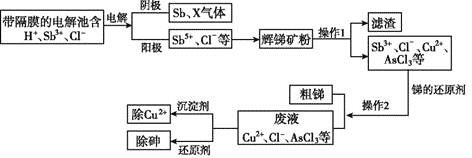
请回答下列问题:
(1)辉锑矿是含锑的重要矿物,其主要成分是![]() ,其中Sb的化合价是____。
,其中Sb的化合价是____。
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式:______________。
(3)电解池所用的“隔膜”宜采用____![]() 填“阳离子”“阴离子”或“质子”
填“阳离子”“阴离子”或“质子”![]() 交换膜。“电解”中阴极反应的产物之一X是____
交换膜。“电解”中阴极反应的产物之一X是____![]() 填化学式
填化学式![]() 。
。
(4)为除去操作1所得滤液中的![]() ,可加入
,可加入![]() 。若滤液中
。若滤液中![]() ,当溶液中
,当溶液中![]() 完全沉淀时,
完全沉淀时,![]() ____
____![]() 。
。 ![]() 已知
已知![]()
(5)除去废液中的![]() ,是用次磷酸钠
,是用次磷酸钠![]() 还原
还原![]() ,产生了棕色单质砷沉淀和
,产生了棕色单质砷沉淀和![]() 。该反应中氧化剂和还原剂的物质的量之比为____。
。该反应中氧化剂和还原剂的物质的量之比为____。
(6)若电解池阴极得到![]() 气体,同时电路中转移
气体,同时电路中转移![]() ,阴极生成的
,阴极生成的![]() ___g。
___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com