
【题目】有X、Y、Z三种元素,已知:①X2﹣、Y﹣均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3 , ZY3溶液遇苯酚呈紫色.
请回答:
(1)Y的最高价氧化物对应水化物的化学式是 .
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 . 此液体具有的性质是(填序号字母).a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体.①已知一定条件下,每1 mol该气体被O2氧化放热98.0kJ.若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为 .
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物.若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 .
【答案】
(1)HClO4
(2)Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+;a、b、d
Fe(OH)3(胶体)+3H+;a、b、d
(3)90%;SO2+2HClO3=H2SO4+2ClO2
【解析】解:有X、Y、Z三种元素,Z与Y可组成化合物ZY3 , ZY3溶液遇苯酚呈紫色,为FeCl3 , 故Z为Fe元素,Y为Cl元素,X2﹣、Y﹣均与Cl元素的气态氢化物分子具有相同的电子数,为18个电子,故X为S元素,(1)Cl元素的最高价氧化物对应水化物的化学式是HClO4 , 所以答案是:HClO4;(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,反应的离子方程式是Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+ , a.氢氧化铁胶体具有丁达尔效应,故a正确; b.胶体胶粒带有正电荷,通直流电后,发生电泳现象,负极附近液体颜色加深,故b正确; c.所得的溶液中含有氯离子,向该液体中加入硝酸银溶液,有沉淀产生,故c错误; d.将该液体加热、蒸干、灼烧后,有氧化铁生成,故d正确;所以答案是:Fe3++3H2O
Fe(OH)3(胶体)+3H+ , a.氢氧化铁胶体具有丁达尔效应,故a正确; b.胶体胶粒带有正电荷,通直流电后,发生电泳现象,负极附近液体颜色加深,故b正确; c.所得的溶液中含有氯离子,向该液体中加入硝酸银溶液,有沉淀产生,故c错误; d.将该液体加热、蒸干、灼烧后,有氧化铁生成,故d正确;所以答案是:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+;abd;(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2 , ①发生反应2SO2+O22SO2 , 1molSO2被O2氧化放热98.0kJ,若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,故参加反应的SO2为
Fe(OH)3(胶体)+3H+;abd;(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2 , ①发生反应2SO2+O22SO2 , 1molSO2被O2氧化放热98.0kJ,若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,故参加反应的SO2为 ![]() ×1mol=1.8mol,故SO2转化率为
×1mol=1.8mol,故SO2转化率为 ![]() ×100%=90%,所以答案是:90%;②Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),故该酸为HClO3 , SO2与含1.5molHClO3溶液在一定条件下反应,可生成一种强酸为和一种氧化物,该强酸为H2SO4 , Cl元素在氧化物中化合价为x,则(5﹣x)×1.5×6.02×1023=1.5×6.02×1023 , 解得x=4,故氧化物为ClO2 , 反应方程式为:SO2+2HClO3=H2SO4+2ClO2 , 所以答案是:SO2+2HClO3=H2SO4+2ClO2 .
×100%=90%,所以答案是:90%;②Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),故该酸为HClO3 , SO2与含1.5molHClO3溶液在一定条件下反应,可生成一种强酸为和一种氧化物,该强酸为H2SO4 , Cl元素在氧化物中化合价为x,则(5﹣x)×1.5×6.02×1023=1.5×6.02×1023 , 解得x=4,故氧化物为ClO2 , 反应方程式为:SO2+2HClO3=H2SO4+2ClO2 , 所以答案是:SO2+2HClO3=H2SO4+2ClO2 .


科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示: 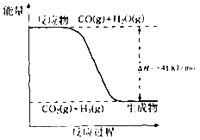
①反应的热化学方程式为 .
②已知:C(s)+H2O (g)═CO(g)+H2(g)△H=+131kJmoL﹣1
则C(s)+CO2(g)═2CO(g)△H= .
(2)化学反应可视为旧键断裂和新键形成的过程.:已知N≡N键的键能是948.9kJmol﹣1 , H﹣H键的键能是436.0kJmol﹣1;N﹣H键的键能是391.55kJ/mol..则 ![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g)△H= .
H2(g)═NH3(g)△H= .
(3)在25℃、101Pa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
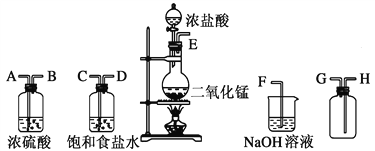
(1)连接上述仪器的正确顺序(填各接口处的字母)____________________。
(2)装置中,饱和食盐水的作用是_____________________;NaOH溶液的作用是____________。
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________________________,反应离子方程式为:__________________。
(4)写出下列化学反应的方程式:
①气体发生装置进行的反应:_________________②NaOH溶液中发生的反应:____________
(5)若将生成的Cl2通入到分别置有干燥有色布条和湿润有色布条的两个集气瓶中,会看到什么现象: _____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夹紧下列装置中的弹簧夹并进行相关操作。下列情形中,表明相应装置漏气的是( )
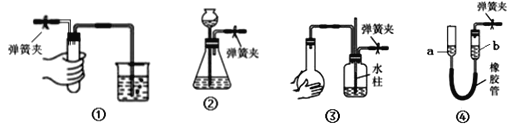
A. 装置①中,用手捂住试管,烧杯中出现气泡,放开手后,导管中形成一段稳定的水柱
B. 装置②中,向长颈漏斗中加入一定量水,形成水柱,随后水柱下降至与瓶中液面相平的位置
C. 装置③中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落
D. 装置④中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应Cu(s)+2Ag+(aq)Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计
A.指针偏转方向如图所示,有关叙述正确的是( ) 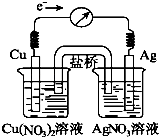
B.KNO3盐桥中的K+移向Cu(NO3)2溶液
C.当电流计指针指向0时,该反应达平衡,平衡常数K=0
D.若向硝酸银溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
E.向硝酸铜溶液中加入NaOH固体,随着NaOH量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.Ⅰ.查阅材料
①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②2Na2S2O4+4HCl═4NaCl+S↓+3SO2↑+2H2O
Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O
(1)制备方法75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+Na2CO3+=Na2S2O4+CO2+
冷却至40℃~45℃,过滤,用洗涤,干燥制得Na2S2O4 .
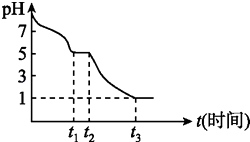
(2)Na2S2O4的性质①Na2S2O4 溶液在空气中易被氧化,课题小组测定0.050 molL﹣1 Na2S2O4 溶液在空气中pH变化如图:0~t1 段主要生成HSO3﹣ , 根据pH变化图,HSO3﹣的电离平衡水解平衡(填“<”或“>”),课题小组推测Na2S2O4 溶液在空气中易被氧化,0~t1 发生离子反应方程式为 . t3 时溶液中主要阴离子符号是 .
②隔绝空气加热Na2S2O4 固体完全分解得到固体产物Na2SO3、Na2S2O3 和气体为(填化学式).请你设计实验验证产物有Na2S2O3 存在,完成下表中内容.(供选择的试剂:稀盐酸、稀硝酸、BaCl2 溶液、KMnO4 溶液)
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( ) 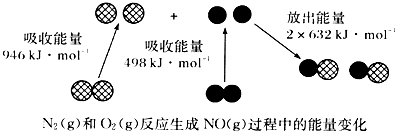
A.1molN2(g)和NA个O2(g)反应放出的能量为180 kJ
B.1molN2(g)和1molO2(g)具有总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.吸热反应一定需要加热才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨可作电极材料、耐高温耐酸材料、铅笔芯等,以下有关石墨的叙述正确的是
①属原子晶体 ②属分子晶体 ③是C60的同素异形体 ④每个碳原子都形成了4个共用电子对
A.①③④B.②③④C.②③D.③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com