
科目:高中化学 来源:教材完全解读:高中化学 2:(必修) (鲁科版课标版) 鲁科版课标版 题型:021
| |||||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:山东省青州一中2012届高三化学一轮跟踪训练:第5章 第3讲 化学键(鲁科版) 题型:022
共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量.如H-H键的键能是436 kJ/mol,是指使1 mol H2分子变成2 mol H原子需吸收436 kJ的能量.
(1)已知H-Cl键的键能为431.4 kJ/mol,下列关于键能的叙述正确的是________.
A.每生成1 mol H-Cl键放出431.4 kJ能量
B.每生成1 mol H-Cl键吸收431.4 kJ能量
C.每拆开1 mol H-Cl键放出431.4 kJ能量
D.每拆开1 mol H-Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是________.
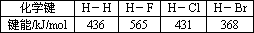
A.HF
B.HCl
C.HBr
D.H2
(3)能用键能大小解释的是________.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243 kJ/mol,试求1 mol H2在足量的Cl2中燃烧,理论上放出的热量是________(其他形式的能量很少,可忽略不计).
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量.如H-H键的键能是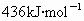 ,是指使
,是指使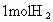 分子变回2molH原子需吸收436kJ的能量.
分子变回2molH原子需吸收436kJ的能量.
(1)已知H-C1键的键能为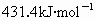 ,下列关于键能的叙述正确的是
,下列关于键能的叙述正确的是
[ ]
A.每生成1molH-C1键放出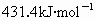 能量
能量
B.每生成1molH-Cl键吸收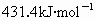 能量
能量
C.每拆开1molH-C1键放出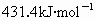 能量
能量
D.每拆开1molH-C1键吸收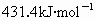 能量
能量
(2)参考下表中键能的数据,判断下列分子受热时最稳定的是
[ ]
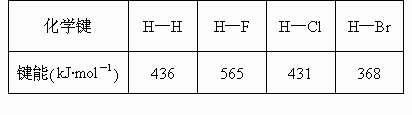
|
A.HF |
B.HCl |
C.HBr |
D. |
(3)能用键能大小解释的是
[ ]
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com