

 CH3OH,根据方程式知,一氧化碳和氢气的物质的量之比是1:2,
CH3OH,根据方程式知,一氧化碳和氢气的物质的量之比是1:2, Ti+2CO↑,故答案为:
Ti+2CO↑,故答案为: Ti+2CO↑;
Ti+2CO↑; =1.8NA,
=1.8NA,

科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 550°C |
| ||
| 550°C |
| 实验编号 | T/℃ | 平衡时压强P/MPa | 起始用量/mol | 平衡时CO的转化率 | 放出热量/kJ | |
| n(H2) | n(CO) | |||||
| Ⅰ | 250 | 2 | 20 | 10 | 90% | a |
| Ⅱ | 250 | P1 | 40 | 20 | c | b |
| 250°C |
| 2MPa |
| a |
| 9 |
| 250°C |
| 2MPa |
| a |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④.。。。。。。。。
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1) 装置A中反应的化学方程式为——————
(2) 第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是——————
(3) 操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)——
(4) 装置B中的冷水作用为——————;装置C的名称为————;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:——
(5) 在虚线框内画出尾气吸收装置E并注明试剂
II.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6) FeCl3与H2S反应的离子方程式为——————————————————
(7) 电解池中H+再阴极放电产生H2,阳极的电极反应为————————
(8) 综合分析实验II的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②——————————————————
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省中山市高三上学期第四次模拟考试化学试卷(解析版) 题型:实验题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
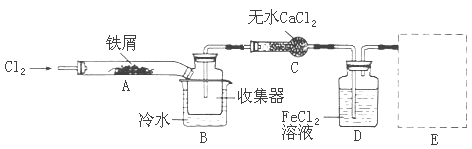
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④ ……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)写出FeCl3溶液吸收有毒的H2S的离子方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中的冷水作用为 ;装置C的名称为 ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,从下面选出检验FeCl2是否完全失效的试剂:___
A.氢氧化钠溶液 B.酸性高锰酸钾溶液 C.硫氰化钾溶液 D.氨水
(5)在虚线框内画出尾气吸收装置E并注明试剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com