
£Ø16·Ö£©ŌŚŅ»øö¹Ģ¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÄ³·“Ó¦£¬µ±øıäĘäĖū·“Ó¦Ģõ¼ž£¬ŌŚI”¢II”¢III½×¶Ī£¬ĢåĻµÖŠø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆµÄĒśĻßČēĻĀĶ¼ĖłŹ¾£ŗ
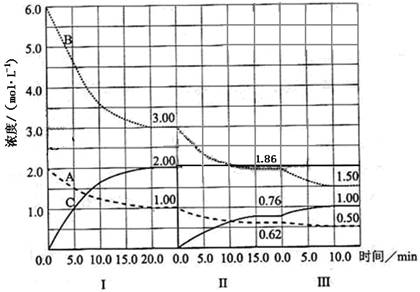
£Ø1£©øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £ØĪļÖŹÓĆĶ¼ÖŠµÄ”°A”±”¢”°B”±”¢”°C”±±ķŹ¾£©£¬øĆ·“Ó¦ŌŚµŚI½×¶ĪµÄĘ½ŗā³£ŹżĪŖ ”£
£Ø2£©µŚIII½×¶Ī£¬“ÓæŖŹ¼ÖĮĘ½ŗā£¬ÓĆB±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ £»
£Ø3£©µŚI½×¶Ī£¬AµÄ×Ŗ»ÆĀŹĪŖ £»µŚIII½×¶Ī“ļĘ½ŗāŗó£¬CµÄĢå»ż·ÖŹżĪŖ ;
£Ø4£©ÓɵŚŅ»“ĪĘ½ŗāµ½µŚ¶ž“ĪĘ½ŗā£¬Ę½ŗāŅĘ¶ÆµÄ·½ĻņŹĒ £¬²ÉČ”µÄ“ėŹ©ŹĒ £»
£Ø5£©ŅŃÖŖµŚ¢ņ½×¶Ī·“Ó¦ĪĀ¶Č£ØT2£©µĶÓŚµŚIII½×¶Ī·“Ó¦ĪĀ¶Č£ØT3£©£¬ŌņøĆ·“Ó¦µÄÕż·“Ó¦
”÷H 0£ØĢī”°<”±»ņ”°>”±£©
¢Å·½³ĢŹ½ĪŖ
A+3B  2C £¬Ę½ŗā³£ŹżĪŖ
4/27 ӣ
2C £¬Ę½ŗā³£ŹżĪŖ
4/27 ӣ
¢Ę 0.036mol/(L”¤min) £»
¢Ē 50% £» 33% ;
¢Č ÕżŅĘ £¬“ėŹ©ŹĒ ½«C“ÓĘ½ŗā»ģŗĻĪļÖŠ·ÖĄė³öČ„ £»¢É”÷H > 0
”¾½āĪö”æA+3B
 2CµŚIII½×¶Ī£¬“ÓæŖŹ¼ÖĮĘ½ŗā£¬ÓĆB±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.36mol£ÆL.10min=0.036mol/(L”¤min).
ÓɵŚŅ»“ĪĘ½ŗāµ½µŚ¶ž“ĪĘ½ŗā£¬Ę½ŗāŅĘ¶ÆµÄ·½ĻņŹĒĻņÕżĻņŅĘ¶Æ£¬æÉŅŌ°ŃC µÄÅØ¶Č¼õŠ””£½«C“ÓĘ½ŗā»ģŗĻĪļÖŠ·ÖĄė³öČ„”£ŅŃÖŖµŚ¢ņ½×¶Ī·“Ó¦ĪĀ¶Č£ØT2£©µĶÓŚµŚIII½×¶Ī·“Ó¦ĪĀ¶Č£ØT3£©£¬ĪĀ¶ČÉżøߣ¬ĻņÕżĻņŅĘ¶Æ£¬ŌņøĆ·“Ó¦µÄÕż·“Ó¦ĪŖĪüČČ·“Ó¦”£”÷H>0
2CµŚIII½×¶Ī£¬“ÓæŖŹ¼ÖĮĘ½ŗā£¬ÓĆB±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.36mol£ÆL.10min=0.036mol/(L”¤min).
ÓɵŚŅ»“ĪĘ½ŗāµ½µŚ¶ž“ĪĘ½ŗā£¬Ę½ŗāŅĘ¶ÆµÄ·½ĻņŹĒĻņÕżĻņŅĘ¶Æ£¬æÉŅŌ°ŃC µÄÅØ¶Č¼õŠ””£½«C“ÓĘ½ŗā»ģŗĻĪļÖŠ·ÖĄė³öČ„”£ŅŃÖŖµŚ¢ņ½×¶Ī·“Ó¦ĪĀ¶Č£ØT2£©µĶÓŚµŚIII½×¶Ī·“Ó¦ĪĀ¶Č£ØT3£©£¬ĪĀ¶ČÉżøߣ¬ĻņÕżĻņŅĘ¶Æ£¬ŌņøĆ·“Ó¦µÄÕż·“Ó¦ĪŖĪüČČ·“Ó¦”£”÷H>0



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 1 |
| 3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com