
| A. | 1.0L1.0mol•L-1的KAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,当活泼金属转移2NA个电子时,可从盐酸中置换产生44.8LH | |
| C. | 6.0g液态NaHS04中含有0.1NA个阳离子 | |
| D. | 1molH202分子中非极性共价键数为NA |
分析 A.水分子中含O原子;
B.由2NA~H2↑可知,生成1mol气体;
C.结合n=$\frac{m}{M}$及分子构成计算;
D.结构为H-O-O-H,1mol分子中含1molO-O非极性键.
解答 解:A.水分子中含O原子,则1.0L1.0mol•L-1的KAlO2水溶液中含有的氧原子数远大于2NA,故A错误;
B.由2NA~H2↑可知,生成1mol气体,则标况下气体体积为22.4L,故B错误;
C.由n=$\frac{m}{M}$及分子构成可知,液态时电离出钠离子和硫酸氢根离子,则6.0g液态NaHS04中含有阳离子为$\frac{6.0g}{120g/mol}$×NA=0.05NA个,故C错误;
D.结构为H-O-O-H,1mol分子中含1molO-O非极性键,则1molH202分子中非极性共价键数为NA,故D正确;
故选D.
点评 本题考查物质的量计算及阿伏伽德罗常数,为高频考点,把握物质的量的相关计算公式、物质构成、化学键判断等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硅胶可作食品干燥剂 | B. | 计算机芯片的主要材料是SiO2 | ||
| C. | 糖类物质都属于高分子化合物 | D. | 地沟油和矿物油都属于酯类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
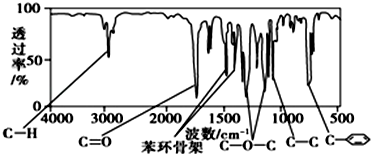
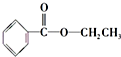 、
、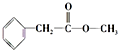 ;
;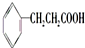 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
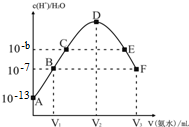
| A. | E溶液中存在:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点溶液pH=14-b | |
| D. | V2=20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 9 6 | B. | 5 6 6 | C. | 3 9 7 | D. | 4 6 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
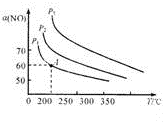 | 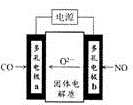 | 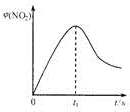 |
| 图1 | 图2 | 图3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
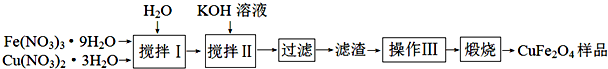

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水中加少量碳酸氢钠:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32+H3O+?HCO3-+H2O3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com