
分析 取50mL的Na2CO3和Na2SO4的混合溶液,加入适量Ba(OH)2溶液50mL后,恰好完全反应,反应的有关化学方程式为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,Na2SO4+Ba(OH)2=BaSO4↓+2NaOH,过滤得到滤液和12.54g白色沉淀(干燥后),再用足量的稀硝酸处理沉淀,最后沉淀减少到4.66g,并有气体放出,BaCO3+2HNO3=Ba(NO3)2+CO2↑,
(1)硫酸钡不溶于酸,最后剩余沉淀为硫酸钡,根据稀硝酸与碳酸钡反应的化学方程式写成离子方程式;
(2)BaSO4的质量为4.66g,物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,BaCO3的质量为:12.54g-4.66g=7.88g,物质的量为:$\frac{7.88g}{197g/mol}$=0.04mol,结合化学方程式定量想计算生成二氧化碳气体体积;
(3)题中发生反应的有关化学方程式为:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,Na2SO4+Ba(OH)2=BaSO4↓+2NaOH,根据硫酸钡沉淀的质量计算出硫酸根离子物质的量,等于硫酸钠的物质的量,计算得到硫酸钠浓度;
(4)结合沉淀物质的量计算生成氢氧化钠物质的量,Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,Na2SO4+Ba(OH)2=BaSO4↓+2NaOH,得到溶液中溶质氢氧化钠的浓度.
解答 解:(1)最后沉淀减少到4.66g,沉淀为BaSO4,12.54g白色沉淀加入稀硝酸后变为4.66g是稀硝酸与碳酸钡反应生成硝酸钡和二氧化碳、水,反应的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaSO4;BaCO3+2H+=Ba2++CO2↑+H2O;
(2)BaSO4的质量为4.66g,物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,BaCO3的质量为:12.54g-4.66g=7.88g,物质的量为:$\frac{7.88g}{197g/mol}$=0.04mol,
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑
1mol 22.4L
0.04moL V
V=0.896L=896ml,
故答案为:896;
(3)BaSO4的质量为4.66g,物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,BaCO3的质量为:12.54g-4.66g=7.88g,物质的量为:$\frac{7.88g}{197g/mol}$=0.04mol,
Na2SO4+Ba(OH)2=BaSO4↓+2NaOH
1mol 1mol
n 0.02mol
n=0.02mol,
c(Na2SO4)=$\frac{0.02mol}{0.05L}$=0.4mol/L,
故答案为:0.4mol/L;
(4)根据反应方程式可知,过滤后,所得溶液为NaOH溶液,物质的量为:2×0.04mol+2×0.02mol=0.12mol,混合后溶液的体积为0.1L,
则过滤出沉淀后,所得滤液的物质的量浓度为$\frac{0.12mol}{0.1L}$=1.2mol/L,
答:所得滤液中溶质的物质的量浓度为1.2mol/L.
点评 本题考查混合物和有关方程式的计算,题目难度中等,注意所发生反应以及有关计算公式的运用,试题能够提高学生的分析、理解、计算能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | Na+,NH4+,NO3-MnO4- | B. | Mg2+,SO42-,K+,Cl- | ||
| C. | K+,Cu2+,Cl-,Br- | D. | Ba2+,Na+,OH-,HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
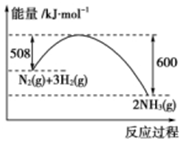 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ①②③⑤⑥ | C. | ③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧被称为绿色氧化剂,无毒无害 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 新制备的氯水中存在3种分子、4种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{14}$C互为同位素 | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | 氟离子结构示意图: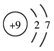 | D. | -OH的电子式: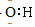 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3水解生成的Fe(OH)3胶粒数为NA | |
| B. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| D. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
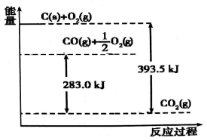
| A. | 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol | |
| B. | 2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol | |
| C. | 2CO2 (g)═2CO(g)+O2(g)△H=+283.0 kJ/mol | |
| D. | C(s)+O2(g)═CO2 (g)△H=+393.5 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com