
ЁОЬтФПЁПИпТЏСЖЬњЕФжївЊЗДгІЮЊЃК3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s)ЃЌвбжЊИУЗДгІдкВЛЭЌЮТЖШЯТЕФЦНКтГЃЪ§ШчЯТЃК
ЮТЖШ/Ёц | 1000 | 1150 | 1300 |
ЦНКтГЃЪ§ | 4.0 | 3.7 | 3.5 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.діМгFe2O3ЙЬЬхПЩвдЬсИпCOЕФзЊЛЏТЪ
B.МѕаЁШнЦїЬхЛ§МШФмЬсИпЗДгІЫйТЪгжФмЬсИпЦНКтзЊЛЏТЪ
C.ИУЗДгІЕФе§ЗДгІІЄH<0
D.ЕБШнЦїФкЦјЬхУмЖШКуЖЈЪБЃЌВЛБъжОИУЗДгІвбДяЕНЦНКтзДЬЌ
ЁОД№АИЁПC
ЁОНтЮіЁП
AЁЂдіМг![]() ЙЬЬхЃЌЦНКтВЛвЦЖЏЃЌдђCOЕФзЊЛЏТЪВЛБфЃЌЙЪAДэЮѓЃЛ
ЙЬЬхЃЌЦНКтВЛвЦЖЏЃЌдђCOЕФзЊЛЏТЪВЛБфЃЌЙЪAДэЮѓЃЛ
BЁЂМѕаЁШнЦїЬхЛ§ЃЌЦјЬхЕФХЈЖШдіДѓЃЌЗДгІЫйТЪМгПьЃЌЕЋЦНКтВЛвЦЖЏЃЌВЛФмЬсИпЦНКтзЊЛЏТЪЃЌЙЪBДэЮѓЃЛ
CЁЂгЩБэИёжаЪ§ОнПЩжЊЃЌЮТЖШдНИпЃЌKдНаЁЃЌдђЩ§ИпЮТЖШЃЌЦНКтФцЯђвЦЖЏЃЌдђ![]() ЃЌЙЪCе§ШЗЃЛ
ЃЌЙЪCе§ШЗЃЛ
DЁЂШнЦїФкЦјЬхУмЖШКуЖЈЪБЃЌЦјЬхЕФжЪСПЁЂЮяжЪЕФСПОљВЛЗЂЩњБфЛЏЃЌдђИУЗДгІвбДяЕНЦНКтзДЬЌЃЌЙЪDДэЮѓЃЛ
ЙЪбЁCЁЃ


 ЬсЗжАйЗжАйМьВтОэЕЅдЊЦкФЉВтЪдОэЯЕСаД№АИ
ЬсЗжАйЗжАйМьВтОэЕЅдЊЦкФЉВтЪдОэЯЕСаД№АИ аЁбЇЦкФЉБъзМЪдОэЯЕСаД№АИ
аЁбЇЦкФЉБъзМЪдОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ:pK=-lgKЃЌ25ЁцЪБЃЌЖўдЊЫсH2AЕФpK1=1.85ЃЌpK2=7.19ЁЃ25ЁцЪБ,гУ0.1mol/LNaOHШмвКЕЮЖЈ20mL0.1mol/LH2AШмвКЕФЕЮЖЈЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. aЕуЫљЕУШмвКжа:Vo=10mL
B. CЕуЫљЕУШмвКжа:c(A2-)=c(HA-)
C. bЕуЫљЕУШмвКжа:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. dЕуЫљЕУШмвКжа:A2-ЕФЫЎНтЦНКтГЃЪ§K1=1ЁС10-7.19
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдгкПЩФцЗДгІЃК2SO2(g)ЃЋO2(g)![]() 2SO3(g)ЃЌЯТСаДыЪЉФмЪЙЗДгІЮяжаЛюЛЏЗжзгАйЗжЪ§ЁЂЛЏбЇЗДгІЫйТЪКЭЛЏбЇЦНКтГЃЪ§ЖМБфЛЏЕФЪЧЃЈ ЃЉ
2SO3(g)ЃЌЯТСаДыЪЉФмЪЙЗДгІЮяжаЛюЛЏЗжзгАйЗжЪ§ЁЂЛЏбЇЗДгІЫйТЪКЭЛЏбЇЦНКтГЃЪ§ЖМБфЛЏЕФЪЧЃЈ ЃЉ
A. діДѓбЙЧП B. Щ§ИпЮТЖШ C. ЪЙгУДпЛЏМС D. ЖрГфO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњПЦбЇМвКЯГЩСЫвЛжжаТЕФЛЏКЯЮяЃЌЦфНсЙЙЪНШчЭМЫљЪОЁЃИУЮяжЪжа WЁЂXЁЂYЁЂZЁЂMЪЧЖЬжмЦкжаГЃМћдЊЫиЃЌЧвдзгађЪ§вРДЮдіДѓЃЛвбжЊMдЊЫидзгКЫЭтЕчзгзмЪ§ЪЧYдЊЫидзгКЫЭт ЕчзгзмЪ§ЕФСНБЖЁЃЯТСаЫЕЗЈжаДэЮѓЕФЪЧ
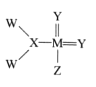
A.гЩXКЭYСНжждЊЫиаЮГЩЕФЛЏКЯЮягаЖржж
B.WКЭZдЊЫиЮЛгкжмЦкБэжаЭЌвЛжїзх
C.дЊЫиЕФЗЧН№ЪєадЧПШѕЫГађЮЊЃКZЃОYЃОX
D.YЁЂMдЊЫиЕФЦјЬЌЧтЛЏЮяЗаЕуИпЕЭЮЊЃКYЃОM
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЃЌЯђвЛИіШнЛ§ЮЊ2LЕФУмБеШнЦїФкЃЈдЄЯШМгШыДпЛЏМСЃЉЭЈШы2molNH3ЃЌОЙ§вЛЖЮЪБМфКѓЃЌВтЕУШнЦїФкЕФбЙЧПЮЊЦ№ЪМЪБЕФ1.2БЖ.дђNH3ЕФзЊЛЏТЪЮЊЃЈЁЁЁЁЃЉ
A. 25%B. 80%C. 10%D. 20%
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАБЦјШмгкЫЎаЮГЩЕФБЅКЭШмвКжаЃЌДцдквдЯТЕФШмНтЦНКтКЭЕчРыЦНКтЃКNH3+H2O![]() NH3H2OЃЌNH3H2O
NH3H2OЃЌNH3H2O![]() NH4++OH-ЃЌетаЉЦНКтЖМТњзуРеЯФЬиСадРэЃЌШєЯђвбДяЕНЦНКтЕФЬхЯЕжаЭЈШыЯТСаЮяжЪЃЌЧыЬюПеЁЃ
NH4++OH-ЃЌетаЉЦНКтЖМТњзуРеЯФЬиСадРэЃЌШєЯђвбДяЕНЦНКтЕФЬхЯЕжаЭЈШыЯТСаЮяжЪЃЌЧыЬюПеЁЃ
ЃЈ1ЃЉМгШыЩйСПАБЦјЃЌЦНКтЯђ___ЃЈЬюЁАе§ЁБЛђЁАФцЁБЃЌЯТЭЌЃЉЗДгІЗНЯђвЦЖЏЁЃ
ЃЈ2ЃЉЭЈШыHClЦјЬхЃЌЦНКтЯђ___ЗДгІЗНЯђвЦЖЏЃЌcЃЈNH4+ЃЉ___ЃЈЬюЁАдіДѓЁБЛђЁАМѕаЁЁБЃЌЯТЭЌЃЉЁЃ
ЃЈ3ЃЉМгШыNaOHЙЬЬхЃЌЦНКтЯђ___ЗДгІЗНЯђвЦЖЏЃЌcЃЈOH-ЃЉ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉвбжЊЃК2H2(g) + O2(g) == 2H2O(g)ЃЛЁїH= ЈC483.6 kJЁЄmol-1, H2(g) + ![]() O2(g) == H2O(l) ЁїH=ЈC285.8 kJЁЄ
O2(g) == H2O(l) ЁїH=ЈC285.8 kJЁЄ![]() ,гЩДЫПЩжЊЃЌдкЕШЮТЯТеєЗЂ45gвКЬЌЫЎашЮќЪе___________kJЕФШШСПЁЃ
,гЩДЫПЩжЊЃЌдкЕШЮТЯТеєЗЂ45gвКЬЌЫЎашЮќЪе___________kJЕФШШСПЁЃ
ЃЈ2ЃЉЙЄвЕжЦЧтЦјЕФвЛИіживЊЗДгІЪЧЃКCO(g)+H2O(g)==CO2(g)+H2(g)ЃЌвбжЊ25ЁцЪБЃК
C(ЪЏФЋ)+O2(g)==CO2(g)ЁїH1ЃНЃ394kJЁЄmol-1
C(ЪЏФЋ)+![]() O2(g)==CO(g)ЁїH2ЃНЃ111kJЁЄmol-1
O2(g)==CO(g)ЁїH2ЃНЃ111kJЁЄmol-1
H2(g)+![]() O2(g)==H2O(g)ЁїH3ЃНЃ242kJЁЄmol-1
O2(g)==H2O(g)ЁїH3ЃНЃ242kJЁЄmol-1
ЪдМЦЫу25ЁцЪБCO(g)+H2O(g)==CO2(g)+H2(g)ЕФЁїH=______kJЁЄmol-1
ЃЈ3ЃЉ дк25ЁцЁЂ101KPaЪБЃЌ___ЪБЫљЗХГіЕФШШСПЃЌНазіИУЗДгІЕФШМЩеШШЁЃдк25ЁцЁЂ101KPaЪБЃЌ1gввДМЭъШЋШМЩеЩњГЩCO2КЭвКЬЌЫЎЪБЗХШШ29.713kJЃЌдђФмБэЪОввДМШМЩеШШЕФШШЛЏбЇЗНГЬЪНЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋ4 mol AЦјЬхКЭ2 mol BЦјЬхдк2 LЕФШнЦїжаЛьКЯВЂдквЛЖЈЬѕМўЯТЗЂЩњШчЯТЗДгІЃК2AЃЈЦјЃЉ+BЃЈЦјЃЉ![]() 2CЃЈЦјЃЉЁЃШєО2 sЃЈУыЃЉКѓВтЕУCЕФХЈЖШЮЊ0.6 molЁЄLЃ1ЃЌЯжгаЯТСаМИжжЫЕЗЈЃК
2CЃЈЦјЃЉЁЃШєО2 sЃЈУыЃЉКѓВтЕУCЕФХЈЖШЮЊ0.6 molЁЄLЃ1ЃЌЯжгаЯТСаМИжжЫЕЗЈЃК
ЂйгУЮяжЪAБэЪОЕФЗДгІЦНОљЫйТЪЮЊ0.3 molЁЄLЃ1ЁЄsЃ1
ЂкгУЮяжЪBБэЪОЕФЗДгІЕФЦНОљЫйТЪЮЊ0.6 molЁЄLЃ1ЁЄsЃ1
Ђл2sЪБЮяжЪAЕФзЊЛЏТЪЮЊ70%
Ђм2sЪБЮяжЪBЕФХЈЖШЮЊ0.7 molЁЄLЃ1
Цфжае§ШЗЕФЪЧЃК
A.ЂйЂлB.ЂйЂмC.ЂкЂлD.ЂлЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊAЪЧвЛжжЗжзгСПЮЊ28ЕФЦјЬЌЬўЃЌЯжвдAЮЊжївЊдСЯКЯГЩвЛжжОпгаЙћЯуЮЖЕФЮяжЪEЃЌЦфКЯГЩТЗЯпШчгвЭМЫљЪО
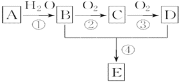
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)аДГіAЕФНсЙЙМђЪН________ЁЃ
(2)BЁЂDЗжзгжаЕФЙйФмЭХУћГЦЗжБ№ЪЧ_____ЁЂ_______ЁЃ
(3)аДГіЗДгІЂйЕФЛЏбЇЗНГЬЪНЃК ____________ ЃЛ ЗДгІРраЭЃК___________ ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com