
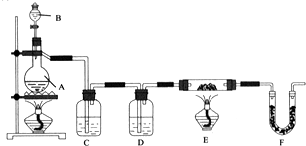
分析 装置A为烧瓶盛放浓硫酸,分液漏斗中盛放甲酸,制备时先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸,发生反应HCOOH$→_{△}^{浓硫酸}$H2O+CO↑,通过装置C中的氢氧化钠溶液吸收挥发出的甲酸,通过装置D中 的浓硫酸吸收气体中的水蒸气,得到干燥气体一氧化碳,通过装置E中和固体铁的氧化物加热反应生成铁和二氧化碳,通过装置F吸收生成的二氧化碳,剩余气体一氧化碳点燃处理,
(1)仪器中分别盛放的试剂分别为甲酸;氢氧化钠溶液;浓硫酸;
(2)该实验装置A仪器中须添加一种玻璃仪器应为温度计,可知反应温度80℃-90℃,防止甲酸挥发,气体发生装置和除杂装置、性质验证装置等需要保持装置气密性;
(3)实验过程中应先点燃烧瓶处酒精灯,生成气体充满装置后再加热装置E处酒精灯,在这两步之间需要检验一氧化碳的纯度,防止进入装置E中的一氧化碳混有空气加热爆炸;
(4)反应过程中F管(内盛碱石灰)逸出的气体是一氧化碳,不能排放到空气中,需要点燃处理;
(5)测得下列数据①空E管的质量为16.6g;②E管和FexOy样品的总质量为27.4g;③反应后冷却至室温称量E管和铁粉的总质量为25.0g(经确认样品全部变为铁粉),得到铁的氧化物质量=27.4g-16.6g=10.8g,生成铁的质量=25.0g-16.6g=8.4g,依据元素守恒计算氧元素和铁元素物质的量得到氧化物化学式;
(6)①甲酸的酸性比碳酸的强,可以设计甲酸和碳酸氢钠溶液反应生成二氧化碳验证酸性强弱;
②Fe2+的氧化性比Cu2+的弱,依据氧化剂影响大于氧化产物设计,把铁放入硫酸铜溶液中反应生成铜和硫酸亚铁证明.
解答 解:装置A为烧瓶盛放浓硫酸,分液漏斗中盛放甲酸,制备时先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸,发生反应HCOOH$→_{△}^{浓硫酸}$H2O+CO↑,通过装置C中的氢氧化钠溶液吸收挥发出的甲酸,通过装置D中 的浓硫酸吸收气体中的水蒸气,得到干燥气体一氧化碳,通过装置E中和固体铁的氧化物加热反应生成铁和二氧化碳,通过装置F吸收生成的二氧化碳,剩余气体一氧化碳点燃处理,
(1)依据分析过程可知,仪器中分别盛放的试剂分别为:B中为甲酸、C中为氢氧化钠溶液、D中为浓硫酸,
故答案为:甲酸;氢氧化钠溶液;浓硫酸;
(2)题干可知反应温度80℃-90℃,该实验装置A仪器中须添加一种玻璃仪器应为温度计,防止甲酸挥发,气体发生装置和除杂装置、性质验证装置等需要保持装置气密性,故答案为:温度计;检查气密性;
(3)实验过程中应先点燃烧瓶处酒精灯,生成气体充满装置后再加热装置E处酒精灯,在这两步之间需要检验一氧化碳的纯度,防止进入装置E中的一氧化碳混有空气加热爆炸,“加热反应管E”和“从B向A逐滴滴加液体”这两步操作应该先进行的是:从B向A逐滴滴加液体,在这两步之间还应进行的操作是检验CO的纯度,
故答案为:从B向A逐滴滴加液体;检验CO的纯度;
(4)反应过程中F管(内盛碱石灰)逸出的气体是一氧化碳,不能排放到空气中,需要点燃或用气球收集处理,
故答案为:CO;在F管出口处点燃或用气球收集;
(5)测得下列数据①空E管的质量为16.6g;②E管和FexOy样品的总质量为27.4g;③反应后冷却至室温称量E管和铁粉的总质量为25.0g(经确认样品全部变为铁粉),得到铁的氧化物质量=27.4g-16.6g=10.8g,生成铁的质量=25.0g-16.6g=8.4g,依据元素守恒计算氧元素和铁元素物质的量得到氧化物化学式n(Fe):n(O)=$\frac{8.4g}{56g/mol}$:$\frac{10.8g-8.4g}{16g/mol}$=1:1,化学式为FeO,
故答案为:FeO;
(6)①甲酸的酸性比碳酸的强,可以设计甲酸和碳酸氢钠溶液反应生成二氧化碳验证酸性强弱,向盛有少量NaHCO3的试管里滴加甲酸溶液有气泡产生,说明甲酸酸性强于碳酸,
故答案为;向盛有少量NaHCO3的试管里滴加甲酸溶液有气泡产生;
②Fe2+的氧化性比Cu2+的弱,依据氧化剂影响大于氧化产物设计,把铁放入硫酸铜溶液中反应生成铜和硫酸亚铁证明,具体操作为:向盛有少量硫酸铜溶液的试管里加入铁粉,振荡,有红色固体出现,溶液由蓝色变为浅绿色,说明铜离子氧化性大于亚铁离子,
故答案为:向盛有少量硫酸铜溶液的试管里加入铁粉,振荡,有红色固体出现,溶液由蓝色变为浅绿色.
点评 本题考查了实验探究物质组成、实验基本操作和实验过程分析是解题关键,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①⑤ | C. | ①②③⑧ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
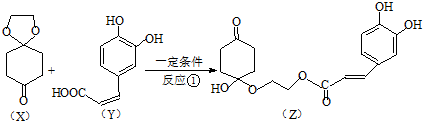
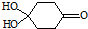 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
(已知烯醇式不稳定,会发生分子重排,例如: ).
). )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为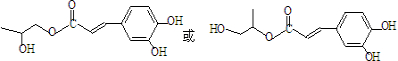 (写一种);
(写一种);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
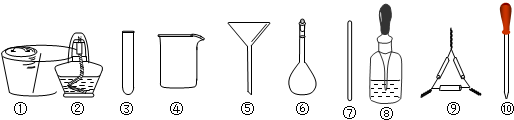
| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
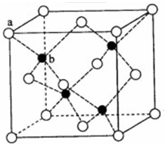 的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形.
的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形. .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
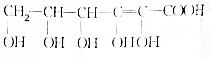 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com