
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
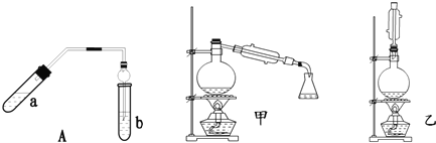
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
【答案】 在试管中加入3 mL乙醇,然后边摇动边加入2 mL浓硫酸和2 mL乙酸; CH3COOH+CH3CH218OH![]() CH3CO18OC2H5+H2O 防止温度过高,乙酸乙醇挥发溢出 2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ 防止倒吸 分液漏斗 乙
CH3CO18OC2H5+H2O 防止温度过高,乙酸乙醇挥发溢出 2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ 防止倒吸 分液漏斗 乙
【解析】
(1)制备乙酸乙酯过程中,浓硫酸起到催化剂和吸水剂的作用;乙酸乙酯的制备反应是可逆反应,为提高反应物的转化率和提高产率,通常采取增大某反应物的浓度或减小生产物的浓度的方法;(2)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;(3)乙酸、乙醇的沸点低,易挥发;(4)乙酸的酸性强于碳酸;(5)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,选择实验方法和仪器进行解答;(6)根据图中甲、乙两个装置的不同点和制取乙酸乙酯的反应原理进行解答;
(1)乙酸乙酯的制备反应,该反应为可逆反应,浓硫酸的作用为催化剂、吸水剂,吸水利于平衡向生成乙酸乙酯方向移动;因该反应为可逆反应,反应中加入过量的乙醇,平衡向正反应方向移动,CH3COOH的转化率增大;浓硫酸的密度比乙醇大,所以后加,溶于水放热,须边加边摇放热混合。步骤①中,配制这一比例的混合液的正确操作是:在试管中加入3 mL乙醇,然后边摇动边加入2 mL浓硫酸和2 mL乙酸;(2)实验中用含18O的乙醇与乙酸作用,酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应,所以乙酸脱羟基,乙醇脱氢离子,18O在产物乙酸乙酯中,故答案为:CH3COOH+CH3CH218OH![]() CH3CO18OC2H5+H2O;(3)乙醇沸点78.0℃、乙酸的沸点117.9℃,它们的沸点较低,为防止乙醇、乙酸挥发,应小火加热,否则易造成原料的损失,步骤③中,要用小火加热,其原因是:防止温度过高,乙酸乙醇挥发溢出;(4)步骤④中可观察到b试管中有细小的气泡冒出,那是生成了二氧化碳,因乙酸的酸性比碳酸强,所以乙酸能和碳酸钠反应生成二氧化碳气体,故2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ ;(5)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,所以用到的仪器为分液漏斗;(6)图中甲、乙两个装置的不同点,乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,而甲不可。
CH3CO18OC2H5+H2O;(3)乙醇沸点78.0℃、乙酸的沸点117.9℃,它们的沸点较低,为防止乙醇、乙酸挥发,应小火加热,否则易造成原料的损失,步骤③中,要用小火加热,其原因是:防止温度过高,乙酸乙醇挥发溢出;(4)步骤④中可观察到b试管中有细小的气泡冒出,那是生成了二氧化碳,因乙酸的酸性比碳酸强,所以乙酸能和碳酸钠反应生成二氧化碳气体,故2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ ;(5)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,所以用到的仪器为分液漏斗;(6)图中甲、乙两个装置的不同点,乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,而甲不可。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。

请按要求填空:
(1)写出上述指定反应的化学反应类型:
反应①____________,反应⑤______________,反应⑧________________。
(2)反应②的化学方程式是___________________________________________。
(3)反应③、④中有一反应是与HCl加成,该反应是__________(填反应编号),设计这一步反应的目的是___________________,物质C的结构简式是____________________。
(4)写出A的同分异构体(要求不含甲基并能发生银镜反应)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是( )

A.若X为导线,Y可以是锌
B.若X为导线,铁闸门上的电极反应式为Fe-2e-=Fe2+
C.若X为直流电源,铁闸门做负极
D.若X为直流电源,Y极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应在密闭容器中进行:A(g)+2B(g)3C(g) ΔH>0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采取的措施是( )

A.恒温恒容条件下将A、B的浓度增加一倍
B.恒温条件下加压(缩小容器体积)
C.使用合适的催化剂
D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,充入2 mol A和1 mol B发生如下反应:2A(g)+B(g) ![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
A.5 B.4 C.3 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气(CO 和H2)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.3kJ/mol
CO(g)+H2(g) △H=+131.3kJ/mol
⑴该反应的平衡常数的表达式为:_________________;升高温度,K值将 ;容器中气体的平均相对分子质量将 。(填“增大”、“减小”或“不变”)。
⑵上述反应达到平衡后,将体系中的C(s)部分移走,平衡将 (填序号)。
A.向左移 B.向右移 C.不移动
⑶下列事实能说明该反应在一定条件下已达到平衡状态的有 (填序号)。
A.单位体积内每消耗1molCO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
⑷上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在图中继续画出t1时刻后c(CO)随时间的变化曲线:
①缩小容器体积(用实线表示)。
②降低温度(用虚线表示)。

⑸某温度下,将4.0mol H2O(g)和足量的炭充入2L的密闭容器中,发生如下反应,C(s)+H2O(g)![]() CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为 。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含着丰富的矿物质。从海水中提取镁的主要过程如下:

![]()
(1)过程Ⅱ中,Mg2+转化为Mg(OH)2沉淀的离子方程式是___。
(2)过程Ⅱ中,分离得到Mg(OH)2沉淀的实验操作名称是___。
(3)下列说法中,正确的是___。
a.过程Ⅰ发生的是物理变化
b.过程Ⅲ中主要发生分解反应
c.过程Ⅳ可以通过电解得到镁
d.过程Ⅰ~Ⅲ的目的是富集、提纯MgCl2
(4)理论上生产24kgMg,需要消耗MgCl2的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
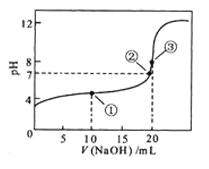
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅是中学常见元素,其单质及化合物有独特的性质和用途。回答问题:
(1)基态碳原子的电子排布图为___,CO2属于___分子(选填“极性”或“非极性”);
(2)60克SiO2晶体中含有的Si-O键数目为___(用NA表示);
(3)有机物M(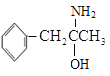 )中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
)中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
(4)碳元素能形成多种单质如金刚石、石墨、C60等,回答下列问题:
(Ⅰ)C60的晶体类型是__晶体。
(Ⅱ)石墨是一种混合晶型,结构中具有的作用力有___。
a.共价键 b.分子间作用力 c.氢键 d.金属键 e.离子键
(Ⅲ)金刚石晶胞结构如图所示,假设金刚石晶胞的边长为a cm,阿伏伽德罗常数为NA,则金刚石的密度可以表示为___g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com