2012年4月15日,中央电视台曝光某些企业用工业明胶制成药用胶囊,流入市场,危害消费者的身体健康.工业明胶生产过程中使用含铬物质做催化剂.铬及其化合物在生产生活中具有十分广泛的用途.
I.交警使用的一种酒精测试仪就利用了K
2Cr
2O
7的强氧化性.反应的原理是2K
2Cr
2O
7+3C
2H
5OH+8H
2SO
4=2Cr
2(SO
4)
3+3CH
3COOH+2K
2SO
4+11H
2O,该反应中若有46g乙醇参加反应,转移电子的数目是
.
Ⅱ.含铬废水必须经过处理与净化才能排放.
化工厂对产生的含Cr
2O
72-的废水通常有如下两种处理工艺:
【工艺一】
利用电解原理:向废水中加入适量的NaCl(增强溶液的导电性),用Fe做电极进行电解,Cr
2O
72-被还原为Cr
3+,然后转化为Cr(OH)
3沉淀除去.
【工艺二】利用原电池原理:在处理池中,焦炭和铁屑与酸性Cr
2O
72-溶液形成原电池,使Cr
2O
72-转化为Cr
3+,再在碱性溶液中把Cr
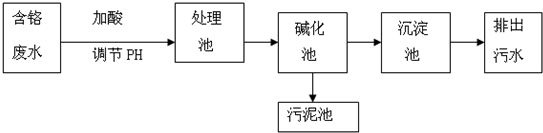
3+沉淀析出.其工艺流程如下图:
(1)【工艺一】中,将Cr
2O
72-转化成Cr
3+的还原剂是
.
(2)【工艺二】中,处理池中原电池反应的总反应式为:
Cr
2O
72-+3Fe+14H
+=2Cr
3++3Fe
2++7H
2O,当消耗28gFe时,转移的电子数是:
.
(3)沉淀池中,可用石灰乳对Cr
3+进行沉降.写出沉降Cr
3+的离子方程式:




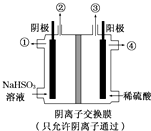 用惰性电极电解NaHSO3溶液可以得到硫酸,装置如图所示.电解过程中①、②、③、④处的生成物依次是( )
用惰性电极电解NaHSO3溶液可以得到硫酸,装置如图所示.电解过程中①、②、③、④处的生成物依次是( )