
分析 (1)亚硝酸(HNO2)是一种弱酸,NaNO2溶液中NO2-离子水解,结合水电离出的氢离子促进水电离,溶液中氢氧根离子浓度增大,溶液显碱性;
(2)2NaNO2+4HI═2NO+I2+2NaI+2H2O中,N元素的化合价降低,I元素的化合价升高,结合电子守恒计算;
(3)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.甲基橙的变色范围是3.1-4.4;
C.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;
(4)常见的大气污染分为一次污染和二次污染,二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下发生变化所生成的新污染物.NaNO2是一种有毒致癌物,直接排放会造成污染,使NaNO2转化为不引起二次污染的N2,需要具有还原性的物质将其氧化生成氮气,据此分析解答.
解答 解:(1)亚硝酸(HNO2)是一种弱酸,NaNO2溶液中NO2-离子水解,结合水电离出的氢离子促进水电离,溶液中氢氧根离子浓度增大,溶液显碱性,离子方程式为:NO2+H2O?HNO2+OH-,
故答案为:>;NO2+H2O?HNO2+OH-;
(2)2NaNO2+4HI═2NO+I2+2NaI+2H2O中,2NaNO2反应,N元素的化合价降低,+3价变化为+2价,电子转移2mol,被氧化HI2mol,I元素的化合价升高,-1价变化为0价电子转移2mol,则NaNO2为氧化剂,HI为还原剂,有0.5mol的还原剂被氧化,则被还原的氧化剂有0.5mol,该过程中转移的电子数为0.5NA,
故答案为:0.5;0.5NA;
(3)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故B选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
故答案为:B;
(4)NaNO2是一种有毒致癌物,使NaNO2转化为不引起二次污染的N2,NaNO2→N2是被还原,必须加还原剂;N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,反应的离子方程式为NO2-+NH4+═N2↑+2H2O,
故答案为:②;NO2-+NH4+═N2↑+2H2O.
点评 本题考查较综合,涉及氧化还原反应、离子检验等,为高频考点,把握发生的反应、物质的性质为解答的关键,侧重分析与计算能力及综合应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在一瓣橘子上相隔0.5 cm分别插上一小块铜片和铝片,把铜片和铝片的另一端通过导线接触耳机的两极,能够从耳机中听到“嘎嘎”声 | |
| B. | 将两朵红色鲜花分别插入食用白醋和纯碱稀溶液中(每天更换上述稀溶液),几天后花的颜色有明显变化 | |
| C. | 将适量的食醋加入内壁有水垢的水瓶中,缓慢转动水瓶,一会儿水垢慢慢脱落 | |
| D. | 向25 mL沸水中滴加5~6滴稀的氯化铁溶液制备氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | b |
| c | d |
| A. | 原子半径:c>b | |
| B. | 气态氢化物的稳定性:b>d | |
| C. | 高温下,a单质可与c的氧化物发生置换反应 | |
| D. | b的最高价氧化物对应的水化物中既含共价键又含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
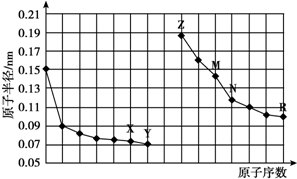
| A. | 简单离子的半径:X<Z<M | |
| B. | Y、R两种元素的气态氢化物稳定性:Y>R | |
| C. | 最高价氧化物对应水化物的酸性:R<N | |
| D. | 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 向硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O═2Fe3++2H2O | |
| C. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | NH4HSO4溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
在一密闭容器中,反应 a A(g) b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a<b+c
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列离子方程式正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO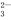 ===CO2↑+H2O
===CO2↑+H2O
B.氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
C.氯化铝溶液加入氨水:Al3++3OH-===Al(OH)3↓
D.用氢氧化钠检验氯化铵溶液中铵根离子:NH +OH―
+OH― NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com