
用NA表示阿伏加德罗常数的值,下列说法正确的是(双选)( )
A.在1 L 0.1 mol·L-1的硫化钠溶液中,阴离子总数大于0.1NA
B.1 mol O2作氧化剂时转移电子数一定为4NA
C.1 mol硫酸钾固体中阴离子所带电荷数为2NA
D.在1 L 1.0 mol·L-1 NaCl溶液中含有NA个NaCl分子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于原子结构及微粒间的数量关系的说法不正确的是(双选)( )
A.同种元素的原子均有相同的质子数和中子数
B.微粒+、Mg2+、O2-具有相同的电子层结构
C.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
D.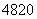 Ca2+的中子数比核外电子数多8
Ca2+的中子数比核外电子数多8
查看答案和解析>>
科目:高中化学 来源: 题型:
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO 、SO
、SO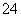 、Cl-、I-、HCO
、Cl-、I-、HCO ,取该溶液进行如下实验:
,取该溶液进行如下实验:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是________;溶液中肯定不存在的离子是____________________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)_________________________ _______________________________________________。
(3)写出实验⑤中所有反应的离子方程式: ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数的值为NA,下列叙述正确的是( )
A.在铜与硫的反应中,1 mol铜参加反应失去的电子数为2NA
B.常温下,32 g含有少量臭氧的氧气中,含有的氧原子数为2NA
C.若1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
D.78 g过氧化钠固体中所含阴、阳离子总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1.8 g重水(D2O)中含有的质子数和电子数均为1.0NA
B.500℃ 30 MPa下,N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1。将分子数为1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3 kJ
C.标准状况下,将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA
D.15 g石英晶体中含有的Si—O键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质应用的说法正确的是( )
A.P2O5可用于干燥Cl2和NH3
B.玻璃容器可长期盛放各种酸
C.浓氨水可检验氯气管道漏气
D.Si和SiO2都用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:__________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO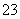 )∶n(HSO
)∶n(HSO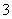 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 1∶91 |
| pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显________性,用化学平衡原理解释:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2SO2(g)+O2 (g) 2SO3(g),下列判断中正确的是( )
2SO3(g),下列判断中正确的是( )
A.2体积SO2和足量O2反应,生成 2体积SO3
B.恒温恒容,通入气体氦使压强增大,平衡向右移动
C.平衡时,SO2消耗速率等于O2生成速率的两倍
D.平衡时,SO2浓度等于O2浓度的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指通常状况下1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量。下列说法正确的是 )。
A.通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2g)+O2g)===2H2Ol) ΔH=-571.6 kJ·mol-1
B.已知:H2g)+F2g)===2HFg) ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3g),放热19.3 kJ,其热化学方程式为N2g)+3H2g)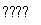 2NH3g) ΔH=-38.6 kJ·mol-1
2NH3g) ΔH=-38.6 kJ·mol-1
D.已知:①Cs,石墨)+O2g)===CO2g) ΔH=-393.5 kJ·mol-1 ②Cs,金刚石)+O2g)===CO2g) ΔH=-395.0 kJ·mol-1,则Cs,金刚石)===Cs,石墨) ΔH=-1.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com