
【题目】按要求填空
(1)某反应的反应过程中能量变化如图所示,回答下列问题:
E逆反应的活化能___E反应的活化能(填“大于”或“小于”)

(2)50mL 0.50mol/L盐酸与50mL 0.55mo/L NaOH溶夜在如图所示的装置中进行中和反应,逋过测定反应过程中所放出的热量可计算中和热,回答下列问题:
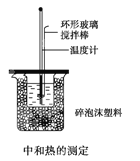
①烧杯间填满碎泡沫塑料作用是________
②实验中改用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等“或“不相等”)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】金属铝在酸性或碱性溶液中均可与NO3﹣发生氧化还原反应,转化关系如下: 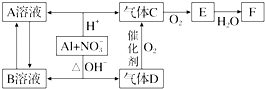
已知,气体D的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,气体D和F反应可生成盐.气体D和A溶液反应生成白色沉淀.气体C为无色气体,气体E为红棕色气体.B溶液加入过量的F溶液能生成A溶液.
请回答下列问题:
(1)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质为 .
(2)完成并配平下列离子方程式:Al+NO3﹣+H+→Al3+++H2O.
(3)D→C反应的化学方程式是 .
(4)除去气体C中的杂质气体E的化学方法:(用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成药物胃复安:
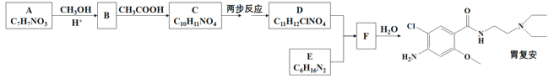
已知: ![]()
请回答:
(1)化合物A的结构简式_______。
(2)下列说法不正确的是_______。
A.化合物B能发生加成反应 B.化合物D能与FeCl3溶液发生显色反应
C.化合物E具有碱性 D.胃复安的分子式是C13H22ClN3O2
(3)设计化合物C经两步反应转变为D 的合成路线(用流程图表示,试剂任选) _______。
(4)写出D+EF的化学方程式_______。
(5)写出化合物E可能的同分异构体的结构简式_______,须同时符合:①1H-NMR谱表明分子中有3种氢原子,IR谱显示有N一H键存在;②分子中没有同一个碳上连两个(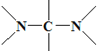 )氮的结构。
)氮的结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
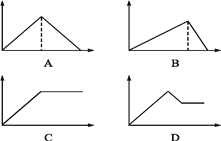
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途均正确,且具有对应关系的是( )
A.硅酸钠易溶于水,可用作木材防火剂
B.小苏打能与碱反应,可用作膨松剂
C.氯气具有漂白性,可用作自来水消毒剂
D.液氨气化时要吸收大量的热,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯催化脱氢制苯乙烯反应:
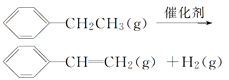
下列说法中不正确的是( )
A. 乙苯的一氯代物共有3种不同结构
B. 苯乙烯和氢气生成乙苯的反应属于加成反应
C. 苯乙烯分子中所有原子有可能位于同一平面上
D. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素在溶液中主要以Mn2+(很浅的肉色,近乎无色)、MnO42-(绿色)、MnO4-(紫色)形式存在。MnO2不溶于稀硫酸。
(1)将8 mL 0.1 mol·L-1的酸性高锰酸钾溶液和2 mL l.0mol/L的草酸(H2C2O4)溶液在试管中混合,然后将试管置于25℃水浴中,KMnO4溶液浓度随时间变化关系如下图所示。

① 写出发生反应的离子方程式:____________
② 计算前40秒用草酸表示的平均反应速率v(草酸)=________________.
③ 40s-65s的反应速率比前40s快,解释原因___________
(2)已知反应3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-。
MnO2+2MnO4-+4OH-。
① 向MnO4-溶液中加入足量稀硫酸,可观察到的现象是__________.
② 常温下,在0.512 mol/L K2MnO4溶液中,当pH=14时K2MnO4的转化率为4/9,则该反应的平衡常数的值为__________
③ 在其他条件不变的条件下,适当升温有利于降低K2MnO4的转化率,则该反应的△H___0(填“大于” “小于”或“等于”)。
(3)碳酸锰是一种重要的工业原料。工业生产中常用复分解法生产MnCO3:
MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4. 溶液的pH不能过低也不能过高,原因是_______。设MnSO4溶液为0.19mol/L,则溶液的pH 最高不能超过_________。
[己知MnCO3、Mn(OH)2的Ksp分别为l.8×10-11和1.9×10-13]
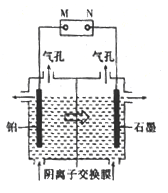
(4)制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中“![]() ”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com