

| A. | 铜作负极 | B. | 锌作正极 | ||
| C. | 电子由铜经导线流向锌 | D. | 锌片上的反应为:Zn-2e-=Zn2+ |
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题
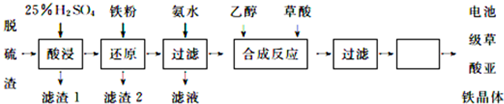
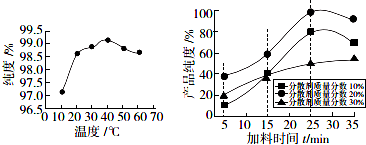
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵与Ba(OH)2•8H2O反应 | B. | 钠与冷水反应 | ||
| C. | 锌片与稀硫酸反应 | D. | 铝粉与三氧化二铁的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硫酸中滴加NaOH:2H++2OH-═2H2O | |
| B. | 向A1C13溶液中加入氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 向BaCl2溶液通入CO2:Ba2++CO2+H2O═BaCO3↓+2 H+ | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-+LV+Ba2++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 0个 | C. | 2个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的浓度为9.2 mol•L-1 | |
| B. | 配制480 mL 4.6 mol•L-1的稀硫酸需该H2SO4 125mL | |
| C. | 该硫酸与等体积水混合质量分数变为49% | |
| D. | 取该硫酸100 mL,则浓度变为原来的$\frac{1}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com