
【题目】常温下,在下列溶液中可能大量共存的离子组是( )
A.pH=0的溶液:Fe2+、Mg2+、NO3﹣、SO42﹣
B.由水电离出的c(H+)=1×10﹣13mol/L的溶液:Al3+、K+、SO42﹣、Cl﹣
C.![]() =1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
=1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
D.pH=14的溶液:Na+、K+、Al3+、CO32﹣
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3 . ①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式 . 已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH= .
②泡沫灭火器中通常装有NaHCO溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式 .
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1 , CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是 . A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收.吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示: 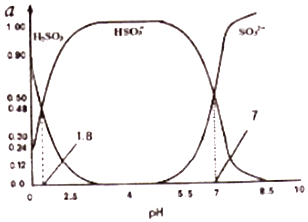
①图中pH=7时,溶液中离子浓度关系正确的是 .
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣ )+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣ )>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3=2H++SO32﹣的平衡常数的数值 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,并回答下列问题: 
(1)判断装置的名称:A池为 .
(2)锌电极反应式为 , 石墨棒C1为极,电极反应式为 , 石墨棒C2附近发生的实验现象为 .
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了g.CuSO4溶液的质量增加了g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡(填“向左”、“向右”或“不”)移动;另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中 ![]() 的比值将(填“增大”、“减小”或“无法确定”).
的比值将(填“增大”、“减小”或“无法确定”).
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)pH(乙).(填“大于”、“小于”或“等于”,下同)
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)V(乙).
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中[Na+]、[CH3COO﹣]的大小关系为:[Na+][CH3COO﹣].
(5)取25mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的C02、N2.电池工作时,下列说法错误的是( )

A. 负极发生的反应为:![]()
B. 正极附近溶液的pH增大
C. 隔膜只允许阳离子通过
D. 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学选修3:物质结构与性质】
翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(l)基态Cr原子的电子排布式为____;Fe位于元素周期表的___ 区。
(2)翡翠中主要成分硅酸锚钠表示为氧化物的化学式为____,其中四种元素第一电离能由小到大的顺序是____。
(3)钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?____。
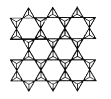
(4)在硅酸盐中存在![]() 结构单元,其中Si原子的杂化轨道类型为____。当无限多个(用n表示)
结构单元,其中Si原子的杂化轨道类型为____。当无限多个(用n表示)![]() 分别以3个顶角氧和其他3个
分别以3个顶角氧和其他3个![]() 形成层状结构时(如图所示),其中Si、O原子的数目之比为____。
形成层状结构时(如图所示),其中Si、O原子的数目之比为____。
若其中有一半的Si被Al替换,其化学式为____。
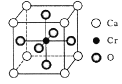
(5) Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为____,若Ca与O的核间距离为x nm,则该晶体的密度为___ g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( ) 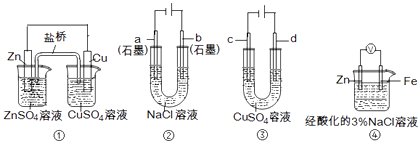
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com