


科目:高中化学 来源: 题型:
| A、增大反应体系的压强,平衡时A的转化率不变 |
| B、反应从开始至达到平衡时,用C、D表示的反应速率之比为3:2 |
| C、若反应的容积不变,反应过程中气体的密度不发生改变 |
| D、在相同温度、相同体积的甲容器里加入1molA、4molB,乙容器里加入5mol C、2mol D,反应达到平衡时,两容器中D的体积分数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:


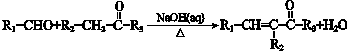
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
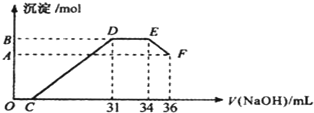
查看答案和解析>>
科目:高中化学 来源: 题型:
 )和抗癫痫药物H(
)和抗癫痫药物H( )的路线如下(部分反应略去条件和试剂):
)的路线如下(部分反应略去条件和试剂):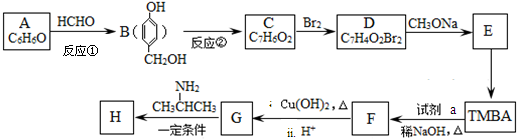
| 释NaOH,△ |
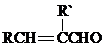 +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢) )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
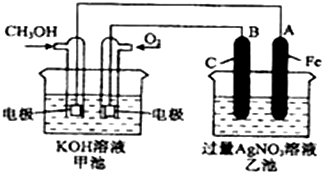
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com