
| A、除去FeCl2溶液中少量的FeCl3:加入稍过量Fe粉后过滤 | B、除去K2CO3固体中少量NaHCO3:置于坩埚中加热至质量不再变化 | C、除去HCl气体中少量Cl2:将其依次通过饱和食盐水、无水CaCl2 | D、除去NaNO3溶液中少量Ba(NO3)2:向其中依次滴加过量Na2CO3溶液、适量盐酸 |


科目:高中化学 来源: 题型:阅读理解
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步 骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步 骤如下:查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波四中高二下学期期末考试化学试卷(带解析) 题型:实验题
(8分)实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | Na2SO4 | (NH4)2SO4 | CaCl2 | MgCl2 | CaSO4 |
| 36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期末考试化学试卷(解析版) 题型:实验题
(8分)实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
(NH4)2SO4 |
CaCl2 |
MgCl2 |
CaSO4 |
|
36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/mL)。
② 精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO42-等杂质),用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是 ;
(2)步骤②中,SO42-是否需要加入某种试剂除去? ,理由是
(3)步骤④中所有操作的共同目的是 ;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是 ,在通常情况下,检验这种阳离子的实验操作为 。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期调考试化学试卷(解析版) 题型:实验题
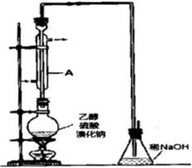
(每空1分,共7分)溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是 。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步骤如下:

①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加 入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
请问答下列问题。
(1)装置A的作用是 。
(2)反应时若温度过高,则有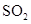 生成,同时观察到还有一种红棕色气体产生,该气体物质的电子式是
。
生成,同时观察到还有一种红棕色气体产生,该气体物质的电子式是
。
(3)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的 (填写上正确选项的字母)。
a.饱和食盐水 b.稀氢氧化钠溶液 c.乙醇 d.四氯化碳
该实验操作中所需的主要玻璃仪器是 (填仪器名称)。
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水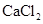 ,然后进行的实验操作是
(填写正确选项的字母)。
,然后进行的实验操作是
(填写正确选项的字母)。
a.分液 b.蒸馏 c.萃取
(5)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后 (按实验的操作顺序选填下列序号)。
①加热 ②加入 溶液 ③加入稀
溶液 ③加入稀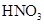 酸化
④加入NaOH溶液
酸化
④加入NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com