
| A. | Zn | B. | Fe | C. | Mg | D. | Al |
分析 标况下22.4L氢气的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,故20g金属提供的电子为1mol×2=2mol,结合化合价计算提供1mol电子需要各金属的质量,混合各组分的质量满足都等于10g或满足有的组分小于10g、有的组分大于10g,以此来解答.
解答 解:标况下22.4L氢气的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,故20g金属提供的电子为1mol×2=2mol,则提供1mol电子需要金属的质量为10g,
A.Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol×$\frac{1mol}{2}$=32.5g;
B.Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×$\frac{1mol}{2}$=28g;
C.Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×$\frac{1mol}{2}$=12g;
D.Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×$\frac{1mol}{3}$=9g;
提供1mol电子,只有Al的质量小于10g,其它金属的质量都大于10g,故金属混合物中一定有Al,
故选D.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意平均值法及电子守恒应用,题目难度不大.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 4.4gCO2、N2O成的混合气体中含有的质子数为2.2NA | |
| B. | 7.8gNa2O2中阴离子数目为0.2NA | |
| C. | 2L0.5mol•L-1(NH4)2SO4溶液中含有的NH4+离子数为2NA | |
| D. | 化学反应中每消耗1molO2,转移的电子数一定是4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
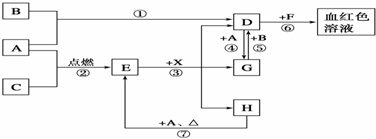
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①③④⑤ | C. | ②③④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
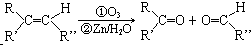

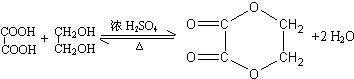 ;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、
;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、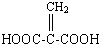 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
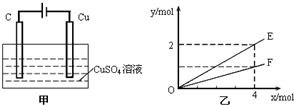
| A. | E表示生成铜的物质的量 | B. | E表示生成硫酸的物质的量 | ||
| C. | F表示反应消耗水的物质的量 | D. | E表示反应生成氧气的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com