
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJmol﹣1
②CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJmol﹣1
O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJmol﹣1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJmol﹣1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJmol﹣1
O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJmol﹣1
【答案】D
【解析】A、反应②生成氢气,不符合燃烧热的概念,A不符合题意;
B、图中表示的是放热反应,而反应①是吸热反应,图象不符合,B不符合题意;
C、据反应①②可知,CH3OH转变成H2的过程不一定要吸收能量,C不符合题意;
D、反应②气态甲醇反应生成二氧化碳和氢气的焓变是﹣192.9kJ/mol;而1 mol液态 CH3OH充分燃烧生成二氧化碳和水放出的热量小于192.9 kJ,D符合题意;
所以答案是:D
【考点精析】利用吸热反应和放热反应和燃烧热对题目进行判断即可得到答案,需要熟知化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应;在101kPa时1mol H2物质完全燃烧生成稳定的氧化物时所放出的能量,叫该物质的燃烧热.


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时,体积均为20 mL、浓度均为0.1mol/L的两种酸HX、HY分别与0.1mol/L的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A. 加入10 mL NaOH溶液时,a点c(X-)<b点c(Y-)
B. b点溶液中,c(Y-)+2c(OH-)=c(HY)+2c(H+)
C. HY中加NaOH溶液至pH=7 时,所得溶液中c(Y-)=c(Na+)=c(OH-)=c(H+)
D. 加入40 mL NaOH 溶液时,2c(Na+)=c(Y-)+c(HY)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2mol氢气燃烧生成液态水时放出572kJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1。
(l)该反应生成物的能量总和__(填“大于”“小于”或“等于”)反应物的能量总和。
(2)若2mol氢气完全燃烧生成水蒸气,则放出的热量__(填“>”“<”或“=”)572kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上第一种重组蛋白质药物即用于治疗糖尿病的胰岛素,组成其分子结构的层次从小到大依次是( )
①氨基酸
②C、H、O、N等元素
③蛋白质
④一条或几条多肽链连接在一起
⑤多肽
A.②→①→⑤→④→③ B.①→③→②→④→⑤
C.②→①→③→④→⑤ D.②→①→④→③→⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为前四周期元素,X与Y位于同一周期。X是生物体中不可缺少的元素之一,它能形成多种化合物。其基态原子中有15种电子运动状态.Y的负一价离子的最外层电子数与次外层的电子数相同;Z是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。
(1)基态X 原子中,电子占据的最高能层符号为_____;该能层中电子占据的能量最高的电子云在空间有___个伸展方向,原子轨道呈_______形.
(2)单质X与单质Y2反应,可以生成XY3和XY5,其中各原子满足最外层8电子稳定结构的化合物中,X原子的杂化轨道类型为________,其分子的空间构型为________。
(3)元素Z基态原子的核外电子排布式为______,其同周期元素中,第一电离能最小的是____(写元素符号)。
(4)Z与Y形成的一种化合物的立方晶胞如图所示.

①该晶胞中,含有____个Y原子。该化合物的化学式为_____,设晶胞棱长为anm,则此晶体密度为____g/cm3(写出计算表达式,摩尔质量用M表示,阿伏伽德罗常数用NA表示)
②该化合物难溶于水但易溶于氨水,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血液中的血红蛋白和肌肉中的肌蛋白结构不同的原因是 ( )
A.所含氨基酸的种类不同,而数目、排列顺序都相同
B.所含氨基酸的数目不同,而种类、排列顺序都相同
C.所含氨基酸的数目、排列顺序不同和多肽链的数目及空间结构不同
D.所含氨基酸的数目、排列顺序和多肽链的数目相同但空间结构不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言描述,下列有关化学用语正确的是()
A. 四氯化碳的比例模型:![]() B. 丙烷分子的球棍模型:
B. 丙烷分子的球棍模型:![]()
C. CO2的电子式: ![]() D. 质量数为37的氯原子: 17 37Cl
D. 质量数为37的氯原子: 17 37Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化氮与过氧化钠反应可以制备亚硝酸钠,反应方程式为:2NO+Na2O2→2NaNO2。一氧化氮可由木炭、浓硝酸、水和铜为原料制备。实验装置图下图所示(部分夹持装置略)。
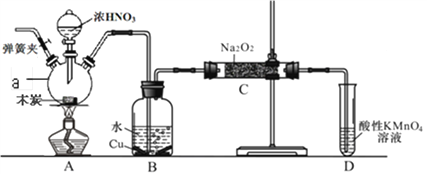

已知:室温下,①3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;
②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)仪器a的名称_________;
(2)写出浓硝酸与木炭反应的化学方程式___________________________________。
(3)B中观察到的主要现象是_____________________________________________。
(4)D装置的作用是______________________________;D中发生反应的离子方程式____________。
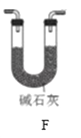
(5)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和______,为避免产生这些副产物应在B、C装置间增加装置_______(填入“E”或“F”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com