
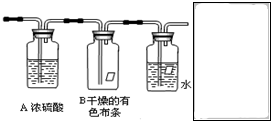
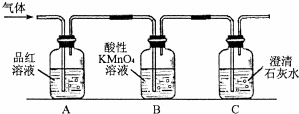
 某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:分析 通过浓硫酸干燥氯气,干燥的氯气通入B,不能使干燥的有色布条褪色,证明干燥的氯气没有漂白性;氯气有毒,装置中应加上尾气吸收装置.
解答 解:(1)氯气中含有水蒸气,需要用浓硫酸干燥,
故答案为:除去水蒸气;
(2)通过盛有干燥的有色布条B,有色布条不褪色说明氯气物漂白性,所以B中观察到的实验现象是有色布条不褪色;
故答案为:有色布条不褪色;
(3)尾气中含有未反应的氯气,所以不能直接排放到空气中,应该在装置C后面添加尾气处理装置,用一个盛有氢氧化钠溶液的烧杯吸收多余的氯气,图为 NaOH溶液;反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O;
NaOH溶液;反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O;
故答案为: NaOH溶液;2NaOH+Cl2═NaCl+NaClO+H2O.
NaOH溶液;2NaOH+Cl2═NaCl+NaClO+H2O.
点评 本题考查了氯气性质的探究实验,题目难度不大,注意把握氯气和次氯酸性质的差别,明确干燥的氯气没有漂白性是解题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g | B. | 64 | C. | 64 g•mol-1 | D. | 32 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
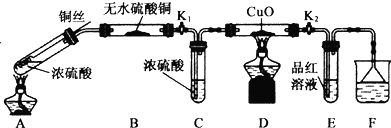
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
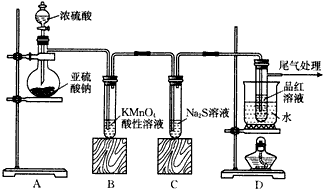
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是常用的化学试剂和重要的化工原料.实验室中我们用浓硫酸做过如下实验.
硫酸是常用的化学试剂和重要的化工原料.实验室中我们用浓硫酸做过如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com