
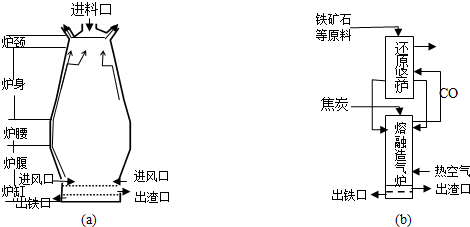
分析 (1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙;加入焦炭,先生成CO,最后生成二氧化碳;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)的△H,因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应.
解答 解:(1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙,涉及反应有CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3,加入焦炭,先生成CO,最后生成二氧化碳,尾气中含有CO,
故答案为:石灰石;CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;CO;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)△H=(+494kJ•mol-1)+3×(-283kJ•mol-1)=-355kJ•mol-1,
因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应,
故答案为:-355;②③;①;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应,则熔融造气炉相当于高炉的炉腹部分,
故答案为:炉腰;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;炉腹;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应,可用碱液或氢氧化钠、氨水等吸收,
故答案为:碱液或氢氧化钠、氨水.
点评 本题为2015年海南考题,涉及高炉炼铁,侧重于化学与生产的考查,综合考查元素化合物知识,有利于培养学生良好的科学素养,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$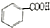
 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O. (任写一种即可).对于化合物X,下列说法正确的是AC.
(任写一种即可).对于化合物X,下列说法正确的是AC. :则Z的同分异构体中,符合
:则Z的同分异构体中,符合 结构且有2个CH3的有3种(不包括Z).
结构且有2个CH3的有3种(不包括Z).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2}{5}$ mol | B. | $\frac{11}{5}$ mol | C. | $\frac{1}{5}$ mol | D. | $\frac{1}{3}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
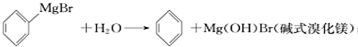
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐 | |
| B. | 由SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可知碳的非金属性大于硅 | |
| C. | CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 | |
| D. | SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极100g,阴极128g | B. | 阳极96.8g,阴极110.8g | ||
| C. | 阳极94.8g,阴极108.8g | D. | 阳极95.9g,阴极114.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com