
【题目】利用如图装置设计实验,制备SO2并进行探究. 
(1)装置A中反应的化学方程式: .
(2)将A中产生的SO2持续通入装置G中直至过量. ①G中有白色沉淀生成,其化学式为 .
②写出反应初始时SO2被氧化的离子方程式: .
(3)选用A~F中的装置验证H2SO4的酸性强于H2CO3 , 能作为依据的实验现象是: .
(4)要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号): A .
【答案】
(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)BaSO4;3SO2+2NO3﹣+2H2O=2NO↑+3SO42﹣+4H+
(3)C中品红溶液(或D中KMnO4溶液)不褪色、E中石灰水变浑浊
(4)B→D→C→F
【解析】解:(1)装置A中反应为制备二氧化硫的反应,化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O; 所以答案是:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;(2)二氧化硫通入D中,被硝酸根氧化为硫酸根,3SO2+2NO3﹣+2H2O=2NO↑+3SO42﹣+4H+ , 与钡离子反应生成硫酸钡沉淀,Ba2++SO42﹣=3 BaSO4↓;所以答案是:①BaSO4;②3SO2+2NO3﹣+2H2O=2NO↑+3SO42﹣+4H+;(3)二氧化硫应该先通入NaHCO3溶液,将生成的气体通入酸性高锰酸钾中吸收二氧化硫气体后,再将气体通入C品红(DKMnO4溶液),品红不褪色(D高锰酸钾),或者E澄清石灰水,澄清石灰水变浑浊,说明生成二氧化碳气体,证明H2SO3>H2CO3 , 又酸性:H2SO4>H2SO3 , 说明H2SO4的酸性强于H2CO3;所以答案是:C中品红溶液(或D中KMnO4溶液)不褪色、E中石灰水变浑浊;(4)要证明H2SO3的酸性强于HClO,因为二氧化硫与次氯酸根离子发生氧化还原反应,不能直接通入漂白粉溶液中,证明酸性H2SO3>H2CO3>HClO即可:应先用二氧化硫制备二氧化碳,制备的二氧化碳中有二氧化硫,故通入漂白粉之前除去二氧化硫气体,再用品红检验二氧化硫是否除净,再通入漂白粉中,故顺序为:A→B→D→C→F;所以答案是:B→D→C→F.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】图为铜﹣锌﹣稀硫酸原电池示意图,下列说法正确的是( ) 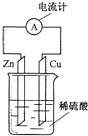
A.电子由铜片通过导线流向锌片
B.锌得电子,被还原
C.锌为负极,铜为正极
D.该装置能将电能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一铜棒和碳棒用导线连接后,插入盛有20%NaC1溶液的U形管中。
(1)若该装置不是原电池,请说明原因:________(如果回答此题,则下面的②不用回答)。
(2)若该装置是原电池,请采取适当的措施(电极材料、溶液浓度均不变)来提高电池的放电效率:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是
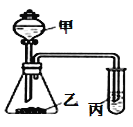
选项 | 甲 | 乙 | __丙 | 装置丙中的现象 | 实验结论 |
A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些含磷洗涤剂含有Na5P3O10,会使水中藻类等浮游生物过量繁殖而造成水体污染。Na5P3O10中磷元素的化合价是( )
A. -2B. +1C. +4D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 漂白粉溶液中通入过量的CO2: Ca2++2ClO-+ CO2+ H2O = CaCO3↓+2HClO
B. 氯气与水的反应: Cl2+H2O![]() 2H++Cl-+ClO—
2H++Cl-+ClO—
C. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3—+Ba2++OH-=BaCO3↓+H2O
D. 钠和冷水反应 : Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol CH4的质量为16g/mol
B. CH4的摩尔质量为16g
C. 标准状况下,O2的摩尔体积约为22.4L/mol
D. 标准状况下,1 mol H2O的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L-1和0.4 mol·L-1。向该混合溶液中加入1.92 g铜粉,加热,待充分反应后(假设反应前 后溶液体积不变),所得溶液中Cu2+的物质的量浓度是( )
A. 0.15 mol·L-1 B. 0.225 mol·L-1
C. 0.30 mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com